28.12.2022
Eine ausreichende Zufuhr der langkettigen Omega-3-Fettsäuren EPA (Eicosapentaensäure) und DHA (Docosahexaensäure) ist wichtig für die Gesundheit und die Vorbeugung bzw. Hemmung einer Vielzahl chronischer (Entzündungs-) Krankheiten, darunter Herz-Kreislauf-Erkrankungen, bestimmte Krebsarten (wie Brustkrebs, Kolorektalkarzinom), Autoimmunkrankheiten, Allergien, Typ-2-Diabetes, Adipositas und Depressionserkrankungen.(1-8) Eine ausreichende DHA-Zufuhr trägt unter anderem zur Vorbeugung von Schwangerschaftskomplikationen, zu einem guten prä- und postnatalen Wachstum und zur (Gehirn-)Entwicklung von Säuglingen und (kleinen) Kindern sowie zur Vorbeugung und/oder Hemmung des altersbedingten kognitiven Verfalls und der Demenz bei.(4,9-11) Die derzeitige westliche Ernährung weist im Vergleich zu der Ernährung während der menschlichen Evolution einen Mangel an (langkettigen) Omega-3-Fettsäuren auf.(4,12) Da die Mehrheit der Europäer zu wenig EPA und DHA mit der Nahrung aufnimmt und die körpereigene Synthese aus der Vorstufe Alpha-Linolensäure unzureichend ist, kann eine tägliche Ergänzung mit EPA und DHA viele gesundheitliche Vorteile bieten.(3,13,14)
Essentielle Fettsäuren
Unsere Nahrung enthält zwei Arten von mehrfach ungesättigten Fettsäuren (Fettsäuren mit zwei oder mehr Doppelbindungen in der Kohlenstoffkette), nämlich Omega-6-Fettsäuren (erste Doppelbindung am sechsten Kohlenstoffatom vom Ende [CH3-Gruppe] des Moleküls) und Omega-3-Fettsäuren (erste Doppelbindung am dritten Kohlenstoffatom). Früher wusste man nur, dass Fette in der Nahrung als Energiequelle dienen und auch Quellen für fettlösliche Vitamine sind. Um 1930 entdeckte das Ehepaar George und Mildred Burr, dass die Omega-6-Fettsäure Linolsäure (C18:2 n-6, eine Omega-6-Fettsäure mit 18 Kohlenstoffatomen und 2 Doppelbindungen) und die Omega-3-Fettsäure Alpha-Linolensäure (C18:3 n-3) ebenso wie Vitamine, Mineralstoffe und essentielle Aminosäuren zu den essentiellen Nährstoffen gehören.(15) Das Fehlen dieser essentiellen Fettsäuren (und ihrer Metabolite) in der Nahrung ist mit dem Leben unvereinbar.
Abbildung 1: Chemische Struktur der wichtigen langkettigen Omega-3-Fettsäuren EPA (Eicosapentaensäure, C20:5 n-3) und DHA (Docosahexaensäure, C22:6 n-3)
Insbesondere die (langkettigen) Metabolite der Linolsäure (Arachidonsäure) und Alpha-Linolensäure (Eicosapentaensäure und Docosahexaensäure, siehe Abbildung 1) haben wichtige physiologische Wirkungen. Arachidonsäure (AA), Docosahexaensäure (DHA) und Eicosapentaensäure (EPA) sind Bestandteile von Phospholipiden in Zellmembranen und Vorstufen von Endocannabinoiden; AA und EPA sind Vorstufen von Eicosanoiden (lokal aktive, parakrine Gewebshormone) und EPA und DHA sind Vorstufen von SPMs (Specialized Pro-resolving Mediators), siehe Abbildung 4.
Unausgewogene Aufnahme von Linolsäure und Alpha-Linolensäure
Quellen für Linolsäure (LA) sind pflanzliche Öle (wie Sonnenblumen-, Distel-, Soja-, Mais-, Sesam-, Kokosnuss-, Palm-, Erdnuss- und Rapsöl), Nüsse, Samen, Fleisch, Hühnchen und Eier. Alpha-Linolensäure (ALA) ist unter anderem in Leinsamen, Hanfsamen, Chiasamen, Walnüssen, grünem Blattgemüse, Avocados, Erdbeeren und in Raps-, Weizenkeim- und Sojabohnenöl enthalten.(4,16) Fleisch und Milchprodukte enthalten den LA-Metabolit Arachidonsäure, während Meeresfrüchte, Fisch(öl), Krillöl und (pflanzliches) Algenöl (aus der Mikroalge Schizochytrium sp.) Quellen für die Omega-3-Fettsäuren EPA und DHA sind.
Es ist sehr wichtig, dass die tägliche Aufnahme von Linolsäure und Alpha-Linolensäure richtig abgestimmt ist. Für die Umwandlung von Linolsäure und Alpha-Linolensäure sind dieselben Enzyme (Desaturasen, Elongase) erforderlich (siehe Abbildung 2), und eine übermäßige Aufnahme von Linolsäure führt zu einer (kompetitiven) Hemmung der Umwandlung von Alpha-Linolensäure und umgekehrt.(4,16,17)

Abbildung 2: Metabolismus von Linolsäure (LA) und Alpha-Linolensäure (ALA); DPA n-3: Docosapentaensäure, Omega-3-Fettsäure; DPA n-6: Docosapentaensäure, Omega-6-Fettsäure.(18)
Das Mengenverhältnis von Linolsäure zu Alpha-Linolensäure in der Nahrung (Verhältnis Omega-6 zu Omega-3) sollte bei etwa 4:1 bis 1:1 liegen, ist aber in der heutigen westlichen Ernährung in der Regel viel höher (10:1 bis 20:1 oder noch höher).(4,17,19) Das bedeutet, dass zusätzlich zu der erhöhten Arachidonsäuresynthese die ohnehin mangelhafte körpereigene Synthese der wichtigen Omega-3-Fettsäuren EPA und DHA weiter verschlechtert wird.(1,18-20) Unter günstigen Bedingungen werden bei Männern bis zu 10 % und bei prämenopausalen Frauen bis zu 21 % der ALA in EPA umgewandelt, während die Synthese von DHA aus ALA bei Männern bis zu 4 % und bei prämenopausalen Frauen bis zu 5-9 % beträgt.(5,21,22) Oft ist die Umsetzung von ALA zu EPA und DHA geringer (etwa 5-8 %), wobei die DHA-Bildung minimal ist.(16) DHA wird nicht, wie bisher angenommen, wieder zu EPA umgesetzt (Rückumwandlung). Eine kürzlich durchgeführte Humanstudie zeigte, dass der Anstieg des EPA-Plasmaspiegels nach einer DHA-Supplementierung auf eine EPA-sparende Wirkung von DHA zurückzuführen ist. Umgekehrt wird ein Teil der supplementierten EPA allerdings in DHA umgewandelt.(23)
Das Enzym Delta-6-Desaturase, das für die Umsetzung von Linolsäure und Alpha-Linolensäure sorgt, ist auch für die Umsetzung von EPA zu DHA erforderlich (siehe Abbildung 2). Aufgrund der Konkurrenz mit ALA und LA wird nach einer ALA-Ergänzung nur wenig DHA aus EPA gebildet. Die östrogenbedingte Zunahme der Aktivität der Delta-6-Desaturase erklärt die etwas bessere Umwandlung von ALA in EPA und DHA bei Frauen, die insbesondere während der Schwangerschaft und Stillzeit mehr DHA für ihr Kind benötigen (u. a. für das Wachstum und die Entwicklung des Nerven- und Immunsystems).(3) Wie gut ALA in EPA und DHA umgesetzt wird, hängt also zum Teil von Faktoren wie dem Geschlecht, einer Schwangerschaft und dem Verhältnis von Omega-6 zu Omega-3 in der Nahrung ab.(21)
Übergewicht und Adipositas
Immer mehr Menschen haben mit Übergewicht oder Adipositas zu kämpfen. Man sollte sich unbedingt darüber im Klaren sein, dass ein hohes Verhältnis von Omega-6 zu Omega-3 in der Ernährung Übergewicht und Fettleibigkeit (und damit zusammenhängend eine nichtalkoholische Fettleber) begünstigt. Dies ist zum Teil auf eine systemische niedriggradige Entzündung, eine Abnahme der Insulinsensitivität, eine Zunahme der Leptinresistenz, eine Dysfunktion des Endocannabinoid-Systems (wodurch der Appetit gesteigert wird), oxidativen Stress und eine Stimulierung der Produktion von Fettgewebe zurückzuführen.(4,17,24) Hinzu kommt, dass die Umwandlung von ALA in EPA (und DHA) bei Übergewicht und Fettleibigkeit noch geringer ist als normal.(5,25) Die Supplementierung mit EPA/DHA und die gleichzeitige Verbesserung des Verhältnisses von Omega-6 zu Omega-3 in der Ernährung ist eine der wichtigsten Maßnahmen zur Bekämpfung von Übergewicht und Fettleibigkeit.(5,17)
EPA und DHA als (bedingt) essentielle Fettsäuren
Die körpereigene Synthese von EPA und DHA aus ALA ist selbst bei ausreichender Zufuhr von Alpha-Linolensäure begrenzt.(26) Daher ist es wichtig, regelmäßig EPA und DHA aus (fettem) Fisch wie Lachs, Hering, Makrele, Sardinen, Schalen- und Krustentieren und/oder Nahrungsergänzungsmitteln (Fisch-, Krill- oder Algenöl) zu sich zu nehmen. Aber selbst dann bleibt eine ausgewogene Zufuhr von Linolsäure und Alpha-Linolensäure ein wichtiger Punkt. Ein hohes Angebot an Arachidonsäure verdrängt EPA und DHA aus den Zellmembranen. Darüber hinaus konkurrieren AA und EPA miteinander bei der Bildung von Eicosanoiden, da für die Umwandlung von AA und EPA dieselben Enzyme (Cyclooxygenasen, Lipoxygenasen) erforderlich sind (siehe Abbildung 4). Hauptrisikogruppen für einen Mangel an langkettigen Omega-3-Fettsäuren sind schwangere und stillende Frauen, Kinder bis zu 2 Jahren, ältere Menschen und Menschen, die (fast) nie Fisch essen.
Niedrige EPA- und DHA-Aufnahme in Europa
Wie viel EPA und DHA pro Tag für eine gute Gesundheit und eine allgemeine Krankheitsprävention benötigt wird, hängt zum Teil davon ab, wie viel Linol- und Alpha-Linolensäure mit der Nahrung aufgenommen wird.(13) In den Niederlanden und in Deutschland liegt die Aufnahme von EPA und DHA bei 0,09 bzw. 0,08 Energieprozent (<200 mg/Tag) oder sogar darunter, während die EPA/DHA-Aufnahme auf Grundlage des Verzehrs von Linolsäure, Arachidonsäure und Alpha-Linolensäure 0,50 Energieprozent (1111 mg/Tag) bzw. 0,57 Energieprozent (1267 mg/Tag) ausmachen sollte.(13) Wenn man sich bemüht, die Zufuhr von Linolsäure auf 2-3 Energieprozent (4,44-6,67 g/Tag) zu halbieren und die Zufuhr von Alpha-Linolensäure auf 1 Prozent (2,22 g/Tag) zu erhöhen, würde eine EPA/DHA-Dosis von etwa 650 mg/Tag (0,3 Energieprozent) ausreichen.(28)
Diese Anpassung der Fettsäurenzufuhr ist für jeden ratsam, insbesondere für Veganer und Vegetarier, die aufgrund einer reichlichen Linolsäurezufuhr (durch einen vermehrten Verzehr pflanzlicher Fette) oft ein noch höheres Omega-6/Omega-3-Verhältnis aufweisen als Allesesser, wobei sie zur zusätzlichen EPA/DHA-Ergänzung auf Algenöl angewiesen sind.(16) Algenöl – im Vergleich zu Fischöl und Krillöl die nachhaltigste und sauberste Quelle für EPA und DHA – enthält im Vergleich zu (konzentriertem) Fischöl weniger EPA und DHA, so dass es außer bei einer ausgewogenen Aufnahme von Linolsäure und Alpha-Linolensäure schwieriger ist, die gewünschte Menge an EPA/DHA aufzunehmen.(16,29)
Die von der EFSA (Europäische Behörde für Lebensmittelsicherheit) empfohlene EPA/DHA-Dosis von 250 mg/Tag (ab einem Alter von 2 Jahren, siehe Tabelle 1) bietet im Allgemeinen keinen ausreichenden Schutz vor einer Erkrankung (oder deren Fortschreiten).(3,30) Diese Menge basiert ausschließlich auf den Ergebnissen von Humanstudien, in denen eine Supplementierung mit 250-500 mg EPA/DHA pro Tag zu einer signifikanten Verringerung des Risikos eines plötzlichen Herztodes oder eines Todes aufgrund einer Erkrankung der Herzkranzgefäße führte.(30) Dabei sind die Empfehlungen für LA (4,0 Energieprozent) und ALA (0,5 Energieprozent) nicht sehr ausgewogen. In 74 % der europäischen Länder liegt die Aufnahme von EPA und DHA in den untersuchten Gruppen (schwangere oder stillende Frauen, Säuglinge, Kinder, Heranwachsende, ältere Menschen) unter der Empfehlung der EFSA.(3)
|
Zielgruppe |
LA |
AA |
ALA |
EPA |
DHA |
EPA + DHA |
|
Schwangerschaft, Stillzeit |
4,0 E% |
– |
0,5 E% |
– |
100-200 mg/Tag |
250 mg/Tag |
|
0-6 Monate |
4,0 E% |
140 mg/Tag |
0,5 E% |
– |
100 mg/Tag |
– |
|
7-24 Monate |
4,0 E% |
– |
0,5 E% |
– |
100 mg/Tag |
– |
|
> 2 Jahre |
4,0 E% |
– |
0,5 E% |
– |
– |
250 mg/Tag |
|
> 65 Jahre |
4,0 E% |
– |
0,5 E% |
– |
– |
250 mg/Tag |
Tabelle 1: Aktuelle europäische Empfehlungen für die Aufnahme mehrfach ungesättigter Fettsäuren (EFSA); E%: Energieprozent.(3,30,31)
Optimaler Omega-3-Index
Ob jemand genügend EPA und DHA für eine gute Gesundheit und den Schutz vor (unter anderem) Herz-Kreislauf-Erkrankungen zu sich nimmt, lässt sich seit 2004 mit dem Bluttest für den HS-Omega-3-Index leicht feststellen.(32) Dieser Fingerpricktest liefert einen schnelleren und besseren Einblick in den Omega-3-Fettsäure-Status (hinsichtlich der langkettigen Fettsäuren) als die Berechnung der EPA- und DHA-Aufnahme aus Nahrungsmitteln und Nahrungsergänzungsmitteln. Der Omega-3-Index (O3I), der prozentuale Gewichtsanteil von EPA und DHA an allen Fettsäuren in den Zellmembranen der roten Blutkörperchen, ist ein zuverlässiger Biomarker für den Omega-3-Fettsäurestatus (langkettig) über einen längeren Zeitraum (80-120 Tage) und korreliert gut mit dem Gehalt an langkettigen Omega-3-Fettsäuren in Geweben und Organen, so auch in Herz, Leber, Gehirn und Nieren.(33,34) Der O3I ist nie niedriger als 2 % und nie höher als 20 % (Sättigungseffekt); der optimale Bereich liegt bei 8-11 %.(35) Ein O3I von 8 % ist ausgezeichnet, aber ein O3I um die 10 % (wie in Japan) bietet wahrscheinlich den besten Schutz vor (letal ausgehenden) Herz-Kreislauf-Erkrankungen.(32,36,37) Europäer haben einen durchschnittlichen O3I von 4,0-4,5 % (Bereich 4-6 %), während in Japan, Grönland und Alaska ein O3I >8 % die Regel ist.(38,39) In einer niederländischen Studie mit Heranwachsenden (13-15 Jahre) lag der O3I bei 3,83 %.(40) Vegetarier und Veganer haben erwartungsgemäß einen niedrigeren O3I (2,7-3,7 %) als Allesesser.(32,36,41) Bei einer westlichen Ernährungsweise ist meist eine Supplementierung mit EPA/DHA erforderlich, um einen O3I von mindestens 8 % zu erreichen, selbst wenn man zweimal pro Woche Fisch isst.(42,43) Fetter Fisch enthält oft weniger EPA und DHA als früher. In Zuchtlachs beispielsweise ist die EPA- und DHA-Konzentration 50 % niedriger als in Wildlachs.(44) Außerdem hängt der EPA/DHA-Gehalt in Fisch von mehreren Faktoren ab (u. a. Fanggebiet, Jahreszeit und Verarbeitungs- und Zubereitungsmethode), so dass man nicht genau weiß, wie hoch die Zufuhr von EPA/DHA tatsächlich ist.
Abbildung 3: Darstellung der Wirkung, die eine bestimmte Dosis EPA/DHA (1 oder 2 g/Tag) auf den Omega-3-Index haben kann. Ob eine bestimmte Dosis EPA/DHA ausreicht, um den optimalen O3I (8-11%) zu erreichen, hängt stark vom O3I-Ausgangswert ab.(26)
Abbildung 3 zeigt, dass der O3I-Ausgangswert in hohem Maße die (individuelle) EPA/DHA-Dosis bestimmt, die erforderlich ist, um den O3I auf über 8 % anzuheben.(26) Außerdem steigt der O3I bei einer bestimmten Dosis stärker an, wenn EPA und DHA nicht in Form von Ethylestern (Fischöl), sondern in Form von Phospholipiden (Krillöl) oder Triglyceriden (Fischöl, Algenöl) zugeführt werden.(29,45) Ein Ergänzungsmittel mit EPA/DHA-Triglyceriden erhöhte in einer Studie den O3I im Vergleich zu EPA/DHA-Ethylestern pro Gramm um 1 % mehr.(45) EPA/DHA-Phospholipide aus Krillöl (das auch Cholin und Astaxanthin enthält) könnten den O3I sogar noch etwas stärker erhöhen als EPA/DHA-Triglyceride, aber völlig schlüssige Beweise dafür liegen noch nicht vor.(4,29,46,47) DHA wird in höherem Maße in die Zellmembranen eingebaut als EPA, selbst bei Nahrungsergänzungsmitteln, die mehr EPA als DHA enthalten, und der O3I steigt bei Nahrungsergänzungsmitteln mit einem hohen DHA-Gehalt schneller an.(27,48) Schließlich spielt die Aufnahme von Linol- und Arachidonsäure im Hintergrund mit und verbessert die intestinale Absorption von EPA und DHA, wenn das Nahrungsergänzungsmittel zusammen mit einer fettreichen Mahlzeit (oft dem Abendessen) eingenommen wird.(26,29,33)
In Studien am Menschen wurden diese Variablen oft nicht berücksichtigt, so dass die Wirkung einer bestimmten Tagesdosis EPA und/oder DHA sehr unterschiedlich sein konnte. Dabei war die Tagesdosis oft zu niedrig, um eine signifikante klinische Wirkung zu erzielen.(45,49) Außerdem könnte der (Zusatz-)Nutzen einer EPA/DHA-Ergänzung durch die Einnahme von Medikamenten eingeschränkt worden sein. Indem man den O3I in der klinischen Diagnostik und in klinischen Studien verwendet, Probanden mit niedrigem O3I auswählt und die EPA/DHA-Dosis stärker individualisiert, könnte die Kontroverse über die Wirksamkeit der EPA/DHA-Supplementierung möglicherweise beigelegt werden.(26,32,35)
Die ungefähre Dosis an EPA/DHA (in Form von Triglyceriden), die erforderlich ist, um in 13 Wochen einen O3I von 8 % zu erreichen, beträgt 2200 mg/Tag bei einem O3I von 2 %, 1500 mg/Tag bei einem O3I von 4 % und 750 mg/Tag bei einem Ausgangswert von 6 %.(45) Damit 95 % der Menschen mit westlicher Ernährungsweise bei einem Ausgangswert von 4 % in 13 Wochen einen O3I von durchschnittlich 8 % erreichen, werden etwa 2000 mg/Tag EPA und DHA benötigt.(45) Die Erhaltungsdosis EPA/DHA, die erforderlich ist, um den O3I bei mindestens 8 % stabil zu halten, liegt im Allgemeinen über 850 mg EPA/DHA pro Tag und kann individuell anhand des O3I festgelegt werden.(26,50,51) Eine kürzlich durchgeführte US-amerikanische Studie ergab, dass Menschen durchschnittlich 1300 mg EPA/DHA pro Tag benötigen, um einen optimalen O3I beizubehalten.(43)
In einer Humanstudie mit 115 gesunden jungen Erwachsenen führte eine 5-monatige Supplementierung mit Fischöl zu einem dosisabhängigen Anstieg des O3I (siehe Tabelle 2).(51) Die Studie zeigt, dass die Empfehlungen der EFSA (Tabelle 1) für einen optimalen O3I nicht ausreichend sind.
|
O3I (%) |
0 mg/Tag |
300 mg/Tag |
600 mg/Tag |
900 mg/Tag |
1800 mg/Tag |
|
Anfangswert |
4,38 % |
4,29 % |
4,28 % |
4,31 % |
4,28 % |
|
Endwert |
4,35 % |
6,19 % |
6,82 % |
7,53 % |
9,49 % |
|
Differenz |
– 0,04 % |
+ 1,88 % |
+ 2,51 % |
+ 3,22 % |
+ 5,19 % |
Tabelle 2: Wirkung einer bestimmten Tagesdosis EPA/DHA auf den Omega-3-Index (O3I) nach 5 Monaten (51)
Allgemeine Wirkungsmechanismen von EPA und DHA
- Bestandteil von Zellmembranen: EPA und (insbesondere) DHA sind Bestandteile von Phospholipiden und Sphingolipiden in Zellmembranen. Sie ermöglichen flexible, gut verformbare, permeable Membranen und beeinflussen die Signalübertragung (wichtig u. a. in Neuronen und Herzmuskelzellen), die Aktivität von Ionenkanälen, Transportern und Enzymen in der Zellmembran sowie die Aktivität von Transkriptionsfaktoren, die die Genexpression regulieren.(4,35) DHA ist die wichtigste langkettige Omega-3-Fettsäure im zentralen und peripheren Nervensystem und in den Augen (Netzhaut).(29)
- Vorstufe zu Eicosanoiden und SPMs: EPA ist – neben AA – eine Vorstufe von Eicosanoiden (siehe Abbildung 4), parakrinen Hormonen, die für die Homöostase wichtig sind (die Aufrechterhaltung des Gleichgewichts interner biochemischer und physiologischer Prozesse während der Anpassung an sich ständig ändernde äußere Bedingungen). Die Homöostase ist wichtig für die Gesundheit und Vitalität, während ihre Störung zu Krankheiten führt.(52) EPA und AA konkurrieren beim Einbau in die Zellmembranen (DHA genauso), bei der Abspaltung von der Zellmembran durch das Enzym Phospholipase A2 (DHA genauso), bei der Umwandlung durch Cyclooxygenasen und Lipoxygenasen und bei den Funktionen ihrer Metabolite. Bei einer hohen Zufuhr von EPA werden mehr Prostanoide des Typs 3 (Prostaglandine, Prostacycline und Thromboxane) und Leukotriene des Typs 5 auf Kosten von Prostanoiden des Typs 2 und Leukotrienen des Typs 4 aus AA gebildet und umgekehrt.(4) Arachidonsäure-Metabolite fördern Entzündungen, Schmerzen, Bronchialverengung, Gefäßverengung, Thrombozytenaggregation und Thrombenbildung. EPA-Metabolite hingegen wirken entzündungshemmend, schmerzlindernd, bronchienerweiternd, gefäßerweiternd und hemmen die Thrombozytenaggregation und Thrombose.(4) Ein zu hohes AA/EPA-Verhältnis in den Zellmembranen führt unter anderem zu einer Zunahme der (lokalen und/oder systemischen) Entzündungsaktivität und zu mehr oxidativem Stress, also zu Faktoren, die eine wichtige Rolle bei der Entstehung und dem Fortschreiten vieler chronischer (Entzündungs) Krankheiten spielen.(4)
EPA und DHA sind Vorläufer von SPMs (Specialized Pro-resolving [lipid] Mediators) wie Resolvinen, Protectinen, Neuroprotectinen und Maresinen (siehe Abbildung 4).(4) SPMs spielen eine Schlüsselrolle bei der aktiven Beendigung von Entzündungen, der Schmerzlinderung und der Verbesserung und Beschleunigung der Geweberegeneration und Wundheilung, dies unter anderem durch die Hemmung der Produktion reaktiver Sauerstoffpartikel und proinflammatorischer Zytokine, die Stimulierung der Produktion entzündungshemmender Zytokine und die Hochregulation von SOD (Superoxiddismutase), HO-1 (Hämoxygenase-1) und Nrf2 (Nuclear Factor Erythroid 2-related Factor 2).(53,54) Bei mikrobiellen Infektionen stimulieren SPMs die Eliminierung der Krankheitserreger (Bakterien, Viren, Pilze, Parasiten).(55) Unter anderen lindern die Resolvine RvE2 und RvD1 sowie das Maresin MaR1 Entzündungsschmerzen.(56,57) SPMs, darunter RvE1, RvD1, RvD2 und MaR1, hemmen die Atherosklerose (bzw. deren Fortschreiten) und begrenzen Ischämie-Reperfusionsschäden (z. B. nach einem Herzinfarkt).(27,58,59)
Abbildung 4: Synthese von Eicosanoiden aus AA und EPA und Synthese von SPMs aus EPA und DHA. COX-1: Cyclooxygenase-1; 5-LOX: 5-Lipoxygenase; Prostanoide: Prostaglandine, Prostacycline und Thromboxane; CytP450: Cytochrom P450.(60,61)
- Vorstufe zu Omega-3-Endocannabinoiden: Aus EPA und DHA können auch Omega-3-Endocannabinoide wie EPA-EA (Eicosapentaenoylethanolamid), EPG (Eicosapentanoylglycerin), DHA-EA (Docosahexaenoylethanolamid oder Synaptamid) und DHG (Docosahexanoylglycerin) gebildet werden.(62) AA ist eine Vorstufe der Omega-6-Endocannabinoide AEA (N-Arachidonoylethanolamin oder Anandamid) und 2-AG (2-Arachidonoylglycerin). Endocannabinoide sind – ebenso wie Eicosanoide – wichtig für die Homöostase im Gehirn und in peripheren Geweben. Die im Gehirn produzierten Endocannabinoide regulieren Prozesse, die mit der Struktur (Neuro- und Gliogenese, Synaptogenese, Neuroplastizität, Neuroprotektion) und der Funktion (mentale und psychische Prozesse, Verhalten, Stresssystem, Stoffwechsel und Gewichtsregulierung, Regulation des Immunsystems, Schmerzwahrnehmung, Motorik, biologische Uhr, Schlaf-Wach-Rhythmus, Atmung, Fortpflanzung, Sexualität) des Gehirns zusammenhängen.(63-65) Endocannabinoide, die an anderen Stellen im Körper (Herz, Muskeln, Leber, Bauchspeicheldrüse, Magen-Darm-Trakt, Immunzellen, Fettgewebe) produziert werden, beeinflussen den Herzrhythmus, den Energiehaushalt, die Immunantwort, die Thrombozytenaggregation, den Blutdruck und die Gefäßerweiterung.(64) Eine Fehlfunktion des Endocannabinoid-Systems aufgrund eines Mangels an EPA und DHA und eines zu hohen Verhältnisses zwischen Omega-6 und Omega-3 in der Nahrung kann bei psychischen Störungen (wie Depressionen, Angststörungen, Aggression, Psychosen, Autismus-Spektrum-Störungen, PTBS, Suizidalität), kognitiver Dysfunktion, neurodegenerativen Erkrankungen (wie Alzheimer, Parkinson, Multiple Sklerose), bei Übergewicht/Fettleibigkeit, Diabetes mellitus Typ 2, Schmerzen, Herz-Kreislauf-Erkrankungen, Entzündungskrankheiten (wie Rheuma), Allergien und Krebs eine Rolle spielen.(63-67)
- Brennstoff: Langkettige Omega-3-Fettsäuren können in den Körperzellen als Energiequelle genutzt werden (ATP-Produktion über Beta-Oxidation) und dadurch die Fettverbrennung durch Regulation von Transkriptionsfaktoren anregen.(4) Im Darm können langkettige Omega-3-Fettsäuren als Präbiotikum für das Darmmikrobiom wirken und die Anzahl der Bakterien erhöhen, die kurzkettige Fettsäuren produzieren und zu den Bakteriengattungen Lactobacillus, Bifidobacterium und Roseburia gehören.(29,68,69) Kurzkettige Fettsäuren haben u. a. entzündungshemmende, immunmodulatorische und krebshemmende Eigenschaften.(29,68)
Pleiotrope Aktivität
EPA und DHA haben eine pleiotrope Aktivität: Über mehrere Wirkmechanismen wird eine bestimmte gesundheitliche Wirkung erzielt. So resultiert die entzündungshemmende Wirkung langkettiger Omega-3-Fettsäuren aus der Beeinflussung von Signalwegen (einschließlich NF-kappa-B und NLRP3-Inflammasom), der Verringerung der Produktion entzündungsfördernder AA-Metabolite, der Steigerung der Produktion entzündungshemmender Eicosanoide und SPMs aus EPA und DHA, der Regulation des Endocannabinoid-Systems und der Steigerung der Produktion entzündungshemmender kurzkettiger Fettsäuren durch das Darmmikrobiom.(64,69)
Korrelation des Status langkettiger Omega-3-Fettsäuren (Omega-3-Index) mit Gesundheit und Krankheit
Herz-Kreislauf-Erkrankungen
Ein optimaler Omega-3-Fettsäurestatus (O3I von 8-11 %) reduziert das Risiko einer (tödlichen) Herz-Kreislauf-Erkrankung, während ein O3I <4 % dieses Risiko erhöht.(26,32,70) Eine Meta-Analyse von 10 Kohortenstudien ergab, dass das Risiko einer tödlichen Erkrankung der Herzkranzgefäße bei einem O3I von 8 % im Vergleich zu einem O3I von 4 % um etwa 30 % geringer war.(50) In einer Humanstudie war ein O3I von 5,0 % im Vergleich zu einem O3I von 3,3 % mit einem um 70 % geringeren Risiko eines akuten Herzstillstands assoziiert.(37) Epidemiologische Studien am Menschen haben einen signifikanten umgekehrten Zusammenhang zwischen dem O3I und Bluthochdruck, kardiovaskulären Ereignissen (wie Herzinfarkt oder Schlaganfall), Herzinsuffizienz, peripheren arteriellen Erkrankungen, kardiovaskulärer Sterblichkeit, Krebssterblichkeit und Gesamtmortalität gezeigt.(32,71-75)
In einer kürzlich durchgeführten Meta-Analyse von 13 großen klinischen Studien mit einer Studiendauer von mindestens 2 Jahren wurde ein linearer Dosis-Wirkungs-Effekt beobachtet, bei dem jede 1000 mg EPA und DHA pro Tag das Risiko für Herz-Kreislauf-Erkrankungen um 17 % und das Risiko für schwerwiegende vaskuläre Ereignisse (nicht-tödlicher Myokardinfarkt, nicht-tödlicher Schlaganfall, Bypass/Stent, kardiovaskulärer Tod) ebenfalls um 17 % reduzierte.(76) Eine tägliche Supplementierung mit einer hohen Dosis EPA/DHA (>/= 3000 mg/Tag) hemmt signifikant das Fortschreiten der Atherosklerose, so das Ergebnis einer kürzlich durchgeführten systematischen Übersichtsarbeit und Meta-Analyse von 6 Humanstudien.(77) Eine Supplementierung mit 2000 mg EPA/DHA über mindestens 5 Tage vor einer koronararteriellen Bypass-Operation reduzierte das Risiko von postoperativem Vorhofflimmern im Vergleich zur Kontrollgruppe um mehr als 50 % (von 33,3 % auf 15,2 %).(37)
Wissenschaftler haben errechnet, dass für den (primären) Schutz des Herzens (vor Ischämie-Reperfusionsschäden, Herzrhythmusstörungen, Herzversagen, plötzlichem Herztod) eine relativ niedrige Dosis EPA und DHA erforderlich ist (zwischen 250 und 1000 mg/Tag), während für den Schutz der Blutgefäße (vor Entzündungen, Hypertriglyceridämie, endothelialer Dysfunktion, Atherosklerose, Thrombose, Bluthochdruck) deutlich mehr EPA und DHA benötigt wird (etwa 3000-4000 mg/Tag).(26,27,37,49) Zur optimalen Unterstützung der Genesung und zur Sekundärprävention nach einem Herzinfarkt wird ebenfalls eine hohe Dosis EPA und DHA (3000-4000 mg/Tag) empfohlen.(37,49,78) Bei Bluthochdruck kann auch eine EPA/DHA-Dosis zwischen 2000 und 3000 mg/Tag ausreichend sein.(241) In einer Humanstudie (GISSI Prevenzione-Studie) reduzierte eine Dosis von 850 mg EPA/DHA pro Tag das Risiko eines plötzlichen Herztodes in der Zeit nach einem Herzinfarkt, ohne das Risiko eines neuen Herzinfarkts zu beeinflussen.(27)
Insbesondere DHA senkt den Blutdruck, wird in die Zellmembranen der Herzmuskelzellen eingebaut und unterstützt die kardiale Leistungsfähigkeit (Senkung der Herzfrequenz, Erhöhung der Herzfrequenzvariabilität, Verringerung von Herzrhythmusstörungen, Verbesserung der Muskelkontraktion und -entspannung), während insbesondere EPA einer Hypertriglyceridämie, Atherosklerose und Thrombose entgegenwirkt.(27) Eine Dosis-Wirkungs-Studie zeigte, dass jedes Gramm, um das die tägliche Dosis von EPA und DHA erhöht wurde, den Triglyceridspiegel um 5,9 mg/dl senkte (linearer Zusammenhang).(76)
Schwangerschaft und Stillzeit
Der O3I (Zielwert 8-11 %) ist ein guter Anhaltspunkt für die Optimierung der DHA-Zufuhr während der Schwangerschaft und Stillzeit.(32,79) Für das Kind ist DHA in der Vorgeburtszeit (insbesondere im dritten Trimester der Schwangerschaft) und in den ersten beiden Lebensjahren im Hinblick auf die Entwicklung, das Wachstum und die Reifung des Gehirns sowie die Entwicklung der Augen (Netzhaut) von entscheidender Bedeutung.(29) Während seines Wachstumsschubs nimmt das Gewicht des Gehirns um das Sechzigfache zu, von 20 Gramm im zweiten Schwangerschaftstrimester auf etwa 1200 Gramm im Alter von zwei Jahren.
In mehreren Übersichtsartikeln wurde festgestellt, dass eine Supplementierung mit langkettigen Omega-3-Fettsäuren (insbesondere DHA) die Schwangerschaftsdauer leicht verlängert und das Risiko von Schwangerschaftskomplikationen wie (extremer) Frühgeburt, perinataler Sterblichkeit, niedrigem Geburtsgewicht und Präeklampsie verringert.(9,29,79-83) Die optimale DHA-Menge zur Vorbeugung einer extremen Frühgeburt (<34 Wochen) bei Frauen mit niedrigem DHA-Status beträgt etwa 1000 mg pro Tag.(84) Die Einnahme dieser DHA-Menge durch schwangere Frauen ist unbedenklich, auch wenn der Fettsäurestatus der langkettigen Omega-3-Fettsäuren bereits vor Beginn der DHA-Supplementierung gut war.(84) Ein optimaler O3I während der Schwangerschaft und Stillzeit ist mit einem geringeren Risiko einer perinatalen Depression bei der Mutter und einer besseren visuellen, neurokognitiven und motorischen Entwicklung des Kindes assoziiert.(29,35,85,86)
Ein guter Status an langkettigen Omega-3-Fettsäuren in der prä- und postnatalen Phase trägt zur Entwicklung eines starken und ausgewogenen Immunsystems bei. Eine systematische Übersichtarbeit und Meta-Analyse von 10 prospektiven Kohortenstudien und 5 Supplementierungsstudien kam zu dem Schluss, dass das Risiko eines Kindes, eine Allergie (z. B. ein Ekzem) zu entwickeln, geringer war, wenn die Mutter während der Schwangerschaft und Stillzeit zusätzlich DHA und EPA eingenommen hatte.(29,87) Eine klinische Studie, in der Kinder 24 Jahre lang beobachtet wurden, kam zu dem Schluss, dass eine Supplementierung mit DHA (und EPA) während der Schwangerschaft mit einem geringeren Asthmarisiko verbunden ist.(88) Eine neuere Meta-Analyse kam zu dem Schluss, dass das Asthmarisiko bei einem Kind nur dann signifikant geringer war, wenn die Mutter während der Schwangerschaft und Stillzeit mindestens 1200 mg langkettige Omega-3-Fettsäuren pro Tag zu sich genommen hatte.(89) Das Asthmarisiko verringerte sich mit jeder Erhöhung der Tagesdosis von EPA/DHA um 100 mg um 2 % (linearer Dosis-Wirkungs-Effekt). Die Zugabe von DHA zur Flaschennahrung (0,32-0,96 % der Gesamtfettsäuren) reduzierte im Vergleich zu Placebo das Auftreten von Allergien in den ersten 3 bis 4 Lebensjahren.(90,91)
Die EFSA empfiehlt Frauen, die schwanger sind oder stillen, zusätzlich zu den 250 mg EPA und DHA pro Tag weitere 100-200 mg DHA einzunehmen (Tabelle 1). Erfahrungsgemäß erreichen viele Frauen diese Menge nicht.(92,93) Dabei ist eine höhere Dosis DHA (und EPA) erforderlich, um den O3I-Wert in den optimalen Bereich zu bringen und dort zu halten.(32) Während der Schwangerschaft transportiert die Plazenta AA und DHA zum Fötus, wobei die fötalen Erythrozyten einen O3I von 7-8 % erreichen.(35,94) Wenn eine Frau nicht genügend DHA zu sich nimmt, wird ihr eigener DHA-Vorrat angezapft, um den DHA-Bedarf des Fötus zu decken. Um sicherzustellen, dass es während der Schwangerschaft und Stillzeit bei der Mutter nicht zu einer DHA-Verarmung kommt, ist die Aufnahme von DHA (+EPA) in einer Menge von etwa 750-1000 mg/Tag erforderlich.(95,96)
Kognition, Psyche und Hirnleistungsstörungen
Eine konstante Versorgung mit ausreichend EPA und DHA ist für die Gesundheit des (zentralen) Nervensystems in allen Lebensabschnitten – insbesondere in jungen Jahren und im Alter – unerlässlich. Insbesondere DHA wird in Zellmembranen eingebaut und ist entscheidend für eine optimale Struktur und Funktion des Gehirns. DHA ist unter anderem an der Regulation der Neurogenese, der Neuroplastizität, des Neuritenwachstums, der Neurotransmission, der Signaltransduktion und der Synaptogenese beteiligt.(35,97) DHA ist wichtig für die Entwicklung und Aufrechterhaltung von kognitiven Funktionen wie Lernen, Konzentration und Gedächtnis sowie für die Geschwindigkeit, mit der (komplexe) kognitive Aufgaben ausgeführt werden.(97) EPA unterstützt die Gehirnfunktion vermutlich vor allem als Vorstufe von Eicosanoiden, die unter anderem der Neuroinflammation entgegenwirken und die Hirndurchblutung verbessern (indem sie die Vasodilatation stimulieren und die Thrombosebildung hemmen), und indem es dem Gehirn als Brennstoff dient (über die Ketogenese).(97) Dabei sind EPA und DHA Vorläufer von SPMs, die Entzündungen hemmen und beenden und die Gewebereparatur fördern, sowie von Endocannabinoiden, die verschiedene Prozesse im Gehirn regulieren.
Humanstudien mit Kindern, Heranwachsenden, (jungen) Erwachsenen und älteren Menschen haben gezeigt, dass ein höherer O3I mit einer besseren Leistung bei komplexen kognitiven Funktionen verbunden ist und dass ein niedriger O3I ein unabhängiger Prädiktor für kognitive Dysfunktion und altersbedingten kognitiven Abbau ist.(32,40,98-104) Eine tägliche Supplementierung mit mindestens 450 mg DHA (und EPA) und einer Erhöhung des O3I-Wertes auf >6 % vergrößert die Wahrscheinlichkeit, die kognitiven Funktionen bei Kindern und Heranwachsenden zu verbessern.(40)
In (epidemiologischen) Studien am Menschen hat sich gezeigt, dass ein niedriger O3I im Vergleich zu einem höheren oder optimalen O3I (8-11%) mit einem höheren Risiko für einen ischämischen Schlaganfall, ein geringeres Hirnvolumen, einen kognitiven Verfall, ein schnelleres Fortschreiten in Richtung Demenz, psychische Störungen (einschließlich Depressionen, bipolare Störungen, Psychosen und Schizophrenie) und eine Störung komplexer Hirnfunktionen assoziiert ist.(35,105) Ab einem Alter von 45 Jahren ist es sinnvoll, mindestens 1000 mg DHA (und EPA) zu sich zu nehmen, um einer Verschlechterung des Gedächtnisses entgegenzuwirken, so das Ergebnis einer systematischen Übersichtsarbeit und Meta-Analyse von Humanstudien.(27) Eine systematische Übersichtsarbeit über Interventionsstudien kam zu dem Schluss, dass eine Supplementierung mit DHA (und EPA) besonders in den Anfangsstadien der Alzheimer-Krankheit positive Auswirkungen hat.(106) Ein guter Status an langkettigen Omega-3-Fettsäuren verbessert die Genesung nach Hirnverletzungen und schützt vor der durch Feinstaub verursachten Hirnalterung.(35,107) Eine geringe Aufnahme von EPA und DHA kann mit der Zeit das Risiko für Multiple Sklerose erhöhen.(108,109) Eine Supplementierung mit einer hohen Dosis EPA und DHA (ab 4 Gramm Fischöl pro Tag) kann bei manifester Multipler Sklerose die Häufigkeit von Schüben und die Konzentration von Entzündungsmarkern (wie TNF-alpha, IL-6, IFN-gamma und IL-1-beta) verringern, das Fortschreiten der Krankheit hemmen und die Lebensqualität verbessern.(109)
Es wird angenommen, dass eine unzureichende Versorgung mit langkettigen Omega-3-Fettsäuren von der Empfängnis bis zum Erwachsenenalter das Risiko für Hirnleistungsstörungen wie ADHS, Autismus-Spektrum-Störungen und depressive Störungen erhöht.(110,111) Eine Supplementierung mit EPA und DHA kann die Symptome dieser Gehirnstörungen lindern, insbesondere wenn der O3I-Wert niedrig und/oder die Entzündungsaktivität hoch ist.(110,112) Eine Supplementierung mit langkettigen Omega-3-Fettsäuren (1300-1500 mg/Tag über 16-24 Wochen) wirkt sich positiv auf Lethargie und Hyperaktivität bei Kindern und Heranwachsenden mit Autismus-Spektrum-Störung aus.(110,111) Bei depressiven Störungen wird – wie bei Erwachsenen – eine Supplementierung mit 1000-2000 mg EPA (das die stärkste antidepressive Wirkung hat) für (mindestens) 12-16 Wochen in Kombination mit DHA in einem EPA:DHA-Verhältnis von 2:1 oder mit mindestens 60 % EPA empfohlen.(110,113) Depressionen gehen mit einem verminderten O3I einher, und es wird angenommen, dass EPA und DHA bei Depressionen synergistische Wirkungen haben.(145) Bei ADHS wird empfohlen, über einen Zeitraum von 16-24 Wochen mindestens 750 mg EPA und DHA zu supplementieren und die EPA-Dosis bei erhöhter Entzündungsaktivität oder Allergie auf 1200 mg/Tag zu erhöhen.(110)
In einer Humanstudie mit gesunden jungen Erwachsenen führte die Einnahme eines DHA-reichen Nahrungsergänzungsmittels (DHA 900 mg/Tag, EPA 270 mg/Tag) über einen Zeitraum von 26 Wochen im Vergleich zu Placebo zu einer Steigerung der Schlafeffizienz (prozentualer Anteil der Schlafdauer an der Gesamtzeit, die für den Schlaf vorgesehen ist), einem schnelleren Einschlafen, einem besseren Durchschlafen, einem längeren Verbleib im Bett, jedoch auch einem weniger erholten Aufstehen.(114) Im Gegensatz dazu führte die Supplementierung mit vornehmlich EPA (EPA 900 mg/Tag, DHA 360 mg/Tag) im Vergleich zu Placebo zu einer nicht signifikanten Verbesserung der Schlafeffizienz, einem kürzeren Bettaufenthalt und einem erholten Erwachen. Insbesondere DHA wirkt sich positiv auf den Schlaf aus, während EPA den Schlafzyklus möglicherweise so reguliert, dass man nicht zu lange oder zu kurz schläft.(114) In einer Humanstudie mit 66 gesunden Erwachsenen (> 45 Jahre) mit Schlafproblemen führte eine Supplementierung mit EPA und DHA (576 bzw. 284 mg pro Tag über 12 Wochen) zu einer signifikanten Verbesserung der Schlafqualität.(115)
Verschiedene Beobachtungen
- Ein niedriger O3I ist mit einer schnelleren biologischen Alterung und einer höheren Sterblichkeit assoziiert.(71,116,117)
- ME/CFS (myalgische Enzephalomyelitis oder chronisches Fatigue-Syndrom) ist mit einem niedrigen O3I-Wert assoziiert.(118)
- Ein O3I <6,6 % ist mit einer erhöhten systemischen Entzündungsaktivität assoziiert, die anhand des NLR (Neutrophilen/Lymphozyten-Verhältnis) gemessen wird, einem Biomarker für systemische Entzündungen und das Gleichgewicht zwischen dem angeborenen und dem erworbenen Immunsystem.(74)
- Patienten mit schwerem COVID-19 haben im Vergleich zu gesunden Kontrollpersonen einen niedrigen O3I, und der O3I ist auch umgekehrt mit der Wahrscheinlichkeit korreliert, auf künstliche Beatmung angewiesen zu sein und/oder zu sterben.(119)
- Ein O3I >5,6 % ist für eine normale Struktur und Funktion der roten Blutkörperchen erforderlich. Diese wird anhand der Erythrozytenverteilungsbreite EVB (engl.: Red blood cell Distribution Width, RDW) gemessen, einem Maß für die Verformbarkeit und Größenvariation der Erythrozyten.(120) Die EVB wird zur Erkennung von Sichelzellenanämie und Anämie aufgrund eines Nährstoffmangels (Folat, Eisen, Vitamin B12) verwendet, ist aber auch ein guter Prädiktor für die Sterblichkeit an Herz-Kreislauf-Erkrankungen, COVID-19, Sepsis, Lungenerkrankungen und Krebs.(120)
- Der O3I ist invers mit dem Risiko korreliert, an Typ-2-Diabetes zu erkranken. Dies ergab eine kürzlich durchgeführte systematische Übersichtsarbeit und Meta-Analyse von 8 asiatischen Patienten-Kontrollstudien.(121) Ein niedriger EPA- und DHA-Gehalt im Fettgewebe, in den roten Blutkörperchen und im Blutplasma oder -serum wurde in einer anderen Meta-Analyse von 20 prospektiven Kohortenstudien aus 14 westlichen Ländern ebenfalls mit einem höheren Risiko für Typ-2-Diabetes korreliert.(122)
- Ein hoher EPA- und DHA-Gehalt im Plasma oder in den Erythrozyten ist mit einem geringeren Risiko für das metabolische Syndrom assoziiert.(123)
- Ausdauersportler haben oft einen niedrigen O3I, der während der Sportsaison noch weiter absinkt, was unter anderem zu mehr Muskelschmerzen, einer langsameren Erholung nach einer sportlichen Anstrengung und zu weniger stabilen Gelenken führen kann.(124-129)
- Aggression und Feindseligkeit werden mit einem verminderten O3I assoziiert; eine Supplementierung mit EPA und DHA kann Aggression und antisoziales Verhalten bei Kindern und Erwachsenen verringern.(130,131)
- In einer Humanstudie war ein hoher Q3I (>/= 8 %) im Vergleich zu einem niedrigeren Q3I (<8 %) mit einer besseren Asthmakontrolle und einem geringeren Bedarf an inhalativen Kortikosteroiden assoziiert.(132)
Eine EPA/DHA-Supplementierung kann auf einen optimalen O3I von 8-11 % abzielen, um eine gute Gesundheit zu erreichen und zu bewahren, Krankheiten allgemein vorzubeugen und das Fortschreiten von Krankheiten zu verhindern. Für eine bestimmte Indikation kann eine Tagesdosis EPA/DHA gewählt werden, die auf Interventionsstudien am Menschen sowie auf systematischen Übersichtsarbeiten und Meta-Analysen von Humanstudien beruht (siehe auch die Literaturverweise bei den einzelnen Indikationen). Die Einnahme von bis zu 5 Gramm EPA und DHA pro Tag verursacht keine spontanen Blutungen oder Blutungskomplikationen und ist für Personen, die gerinnungshemmende Medikamente einnehmen, sicher.(133)
Überblick über die Indikationen für eine Supplementierung mit EPA/DHA
- Alterung: biologische Alterung (116), systemische niedriggradige Entzündungen (134), ‘Inflammaging’ (135,136);
- Schwangerschaft und Stillzeit (32,79,80,95,96);
- Herz und Blutgefäße: Bluthochdruck (27,240,241), Atherosklerose (58,59), koronare Herzerkrankung (239), Herzinfarkt (27,37,49), Herzrhythmusstörungen (27,37,137,138), Herzinsuffizienz (139), Schlaganfall (140-142), Atherothrombose (143), venöse Thromboembolie (144), periphere Gefäßerkrankung (72);
- Stoffwechsel: Übergewicht/Adipositas (4,17,146), metabolisches Syndrom (123,147,148), Typ-2-Diabetes (121,122,149), Schwangerschaftsdiabetes (150,151), Hypertriglyceridämie (27,76,152);
- Leber und Gallenblase: nicht-alkoholische Fettleber (153,154), Gallensteine (155,156);
- Augen: altersbedingte Makuladegeneration (AMD) (157-159), erhöhter Augeninnendruck (160), Glaukom (161,162), diabetische Retinopathie (163,164), allergische Bindehautentzündung (165), trockene Augen (166-168) und möglicherweise Myopie (Kurzsichtigkeit) (169);
- Gehirn/Nervensystem: Unterstützung der Gehirnentwicklung bei Kindern und Heranwachsenden und der (komplexen) Gehirnfunktionen in jedem Alter (32,35,97-99,101), altersbedingter kognitiver Abbau (101,104), Demenz/Alzheimer (10,11,106,145), Multiple Sklerose (108,109), Migräne (170,171), chronische Kopfschmerzen (172,173), Hirnverletzungen (174,175), neuropathische Schmerzen (176,177);
- Psyche: psychischer Stress (178,179), berufsbedingter Burnout (180,181), PTBS (posttraumatische Belastungsstörung) (130), ADHS (110), Anorexia nervosa (182), Borderline-Persönlichkeitsstörung (183), Aggression/Feindseligkeit (130,131,184) 185), Impulsivität (185), Angststörung (186), Depression (133,184), Prävention der postpartalen Depression (79,85,86), bipolare Störung (187,188), Suizidalität (184), Schizophrenie (189,190), Psychose (105), Autismus-Spektrum-Störung (110);
- Bewegungsapparat: rheumatoide Arthritis (191), Osteoarthritis (192,193), Schmerzen im unteren Rückenbereich (194), Sarkopenie (unter anderem bei älteren Menschen und Menschen mit Adipositas, Krebs, COPD, Herzinsuffizienz, Rheuma, Typ-2-Diabetes) (195-198), Osteoporose (Prävention) (2,196);
- Sport (124-129);
- Parodontitis (199);
- Allergie: Asthma (89,132), atopische Dermatitis (200,201), allergische Bindehautentzündung (201), allergische Rhinitis (202,203);
- Autoimmunität (8), SLE (systemischer Lupus erythematodes) (204);
- Krebs: Prävention (6,7), bessere Verfassung und Lebensqualität (205-207), Kachexie (208-209);
- Prävention kolorektaler Adenome (210);
- Fortpflanzung: männliche und weibliche Sub- und Infertilität (211-214), assistierte Reproduktion einschließlich In-vitro-Fertilisation (215,216);
- Menstruation: prämenstruelles Syndrom (217), Dysmenorrhoe (218); PCOS (polyzystisches Ovarialsyndrom) (219,220);
- Gastrointestinaltrakt: stressbedingte Magengeschwüre (221), RDS (Reizdarmsyndrom) (222), entzündliche Darmerkrankungen (223);
- Haut: Ulcus cruris venosum (224), Ulcus cruris (offenes Bein) (224), Akne vulgaris (200), Psoriasis (200), Verlangsamen der Hautalterung (225);
- Atemwege: Asthma (89,226), COPD (227), COVID-19 (119,228,229);
- Schlaf: schlechter Schlaf (114,115), Schlafapnoe (230,231);
- Nieren: chronisches Nierenversagen (232-234), Vorbeugung von Nierensteinen (Calciumoxalat) (235);
- Blut: Sichelzellenanämie (236-238).
Literaturverweise
1. Simopoulos AP. Evolutionary aspects of diet, the omega-6/omega-3 ratio and genetic variation: nutritional implications for chronic diseases. Biomed Pharmacother. 2006;60:502-7.
2. Dou Y et al. Effect of n-3 polyunsaturated fatty acid on bone health: a systematic review and meta-analysis of randomized controlled trials. Food Sci Nutr. 2021;10(1):145-54.
3. Sioen I et al. Systematic review on n-3 and n-6 polyunsaturated fatty acid intake in European countries in light of the current recommendations – focus on specific population groups. Ann Nutr Metab. 2017;70(1):39-50.
4. Mariamenatu AH et al. Overconsumption of omega-6 polyunsaturated fatty acids (PUFAs) versus deficiency of omega-3 PUFAs in modern-day diets: the disturbing factor for their “balanced antagonistic metabolic functions” in the human body. J Lipids. 2021;2021:8848161.
5. Takic M et al. Effects of dietary alpha-linolenic acid treatment and the efficiency of its conversion to eicosapentaenoic and docosahexaenoic acids in obesity and related diseases. Molecules. 2022;27:4471.
6. Nindrea RD et al. Association of dietary intake ratio of n-3/n-6 polyunsaturated fatty acids with breast cancer risk in Western and Asian cCountries: a meta-analysis. Asian Pac J Cancer Prev. 2019;20(5):1321-7.
7. Lee JY et al. Chemopreventive and chemotherapeutic effects of fish oil derived omega-3 polyunsaturated fatty acids on colon carcinogenesis. Clin Nutr Res. 2017;6(3):147-60.
8. Li X et al. Therapeutic potential of Omega-3 polyunsaturated fatty acids in human autoimmune diseases. Front Immunol. 2019;10:2241.
9. Middleton P et al. Omega-3 fatty acid addition during pregnancy. Cochrane Database Syst Rev. 2018;11:CD003402.
10. Wood AH et al. Dietary and supplemental long-chain omega-3 fatty acids as moderators of cognitive impairment and Alzheimer’s disease. Eur J Nutr. 2022;61(2):589-604.
11. Liu X et al. Association of fish oil supplementation with risk of incident dementia: a prospective study of 215,083 older adults. Clin Nutr. 2022;41(3):589-98.
12. Simopoulos AP. Evolutionary aspects of diet: the omega-6/omega-3 ratio and the brain. Mol Neurobiol. 2011;44:203-15.
13. Hibbeln JR et al. Healthy intakes of n-3 and n-6 fatty acids: estimations considering worldwide diversity. Am J Clin Nutr. 2006;83(Suppl. 6):1483S-93S.
14. Stark K et al. Global survey of the omega-3 fatty acids, docosahexaenoic acid and eicosapentaenoic acid in the blood stream of healthy adults. Prog Lipid Res. 2016;63:132-52.
15. Spector AA et al. Discovery of essential fatty acids. J Lipid Res. 2015;56(1):11-21.
16. Burns-Whitmore B et al. Alpha-linolenic and linoleic fatty acids in the vegan diet: do they require dietary reference intake/adequate intake special consideration? Nutrients. 2019;11:2365.
17. Simopoulos AP. An increase in the omega-6/omega-3 fatty acid ratio increases the risk for obesity. Nutrients. 2016;8(3):128.
18. Gibson RA et al. Docosahexaenoic acid synthesis from alpha-linolenic acid is inhibited by diets high in polyunsaturated fatty acids. Prostaglandins Leukot Essent Fatty Acids. 2013;88:139-46.
19. Simopoulos AP. Importance of the omega-6/omega-3 balance in health and disease: evolutionary aspects of diet. World Rev Nutr Diet. 2011;102:10-21.
20. Simopoulos A. The importance of the omega6/omega 3 fatty acid ratio in cardiovascular disease and other diseases. Exp Bio Med. (Maywood) 2008;223:674-88.
21. Williams CM et al. Long-chain n-3 PUFA: plant v. marine sources. Proc Nutr Soc. 2006;65(1):42-50.
22. Burdge GC et al. Conversion of alpha-linolenic acid to eicosapentaenoic, docosapentaenoic and docosahexaenoic acids in young women. Br J Nutr. 2002;88:411-20.
23. Metherel AH et al. Compound-specific isotope analysis reveals no retroconversion of DHA to EPA but substantial conversion of EPA to DHA following supplementation: a randomized control trial. Am J Clin Nutr 2019;110:823-31.
24. Valenzuela R et al. The importance of the long-chain polyunsaturated fatty acid n-6 / n-3 ratio in development of non-alcoholic fatty liver associated with obesity. Food Funct. 2011;2:644-8.
25. Fekete K et al. Long-chain polyunsaturated fatty acid status in obesity: a systematic review and meta-analysis. Obes Rev. 2015;16:488-97.
26. Elagizi A et al. An update on omega-3 polyunsaturated fatty acids and cardiovascular health. Nutrients. 2021;13(1):204.
27. Yurko-Mauro K. Docosahexaenoic acid and adult memory: a systematic review and meta-analysis PLoS One. 2015;10(3):e0120391.
28. Simopoulos AP et al. Workshop statement on the essentiality of and recommended dietary intakes for omega-6 and omega-3 fatty acids. Prostaglandins Leukot Essent Fatty Acids. 2000;63(3):119-21.
29. Li J et al. Health benefits of docosahexaenoic acid and its bioavailability: a review. Food Sci Nutr. 2021;9:5229-43.
30. European Food Safety Authority NDA Panel. Scientific opinion on dietary reference values for fats, including saturated fatty acids, polyunsaturated fatty acids, monounsaturated fatty acids, trans fatty acids, and cholesterol. EFSA J. 2010;8:1461.
31. EFSA Panel on Dietetic Products Nutrition and Allergies Scientific opinion on nutrient requirements and dietary intakes of infants and young children in the European union. EFSA J. 2013;11:3408.
32. Von Schacky C. Omega-3 index in 2018/19. Proc Nutr Soc. 2020 May 11:1-7.
33. Cholewski M et al. A comprehensive review of chemistry, sources and bioavailability of omega-3 fatty acids. Nutrients. 2018;10(11). pii: E1662.
34. O’Keefe EL et al. Sea change for marine omega-3s: randomized trials show fish oil reduces cardiovascular events. Mayo Clin Proc. 2019;94:2524-33.
35. Von Schacky C. Importance of EPA and DHA blood levels in brain structure and function. Nutrients. 2021;13(4):1074.
36. Sarter B et al. Blood docosahexaenoic acid and eicosapentaenoic acid in vegans: associations with age and gender and effects of an algal-derived omega-3 fatty acid supplement. Clin Nutr. 2015;34:212-18.
37. DiNicolantonio JJ et al. The benefits of marine omega-3s for preventing arrhythmias. Open Heart. 2020;7(1):e000904.
38. Stark KD et al. Global survey of the omega-3 fatty acids, docosahexaenoic acid and eicosapentaenoic acid in the blood stream of healthy adults. Prog Lipid Res. 2016;63:132-52.
39. Schuchardt JP et al. Red blood cell fatty acid patterns from 7 countries: focus on the omega-3 index. Prostaglandins Leukot Essent Fatty Acids. 2022;179:102418.
40. Van der Wurff IS et al. Effect of omega-3 long chain polyunsaturated fatty acids (n-3 LCPUFA) supplementation on cognition in children and adolescents: a systematic literature review with a focus on n-3 LCPUFA blood values and dose of DHA and EPA. Nutrients. 2020;12(10):3115.
41. Pinto AM et al. A comparison of heart rate variability, n-3 PUFA status and lipid mediator profile in age- and BMI-matched middle-aged vegans and omnivores. Br J Nutr. 2017;117:669-85.
42. Jackson KH et al. Association of reported fish intake and supplementation status with the omega-3 index. Prostaglandins Leukot Essent Fatty Acids. 2019;142:4-10.
43. McDonnell SL et al. Cross-sectional study of the combined associations of dietary and supplemental eicosapentaenoic acid + docosahexaenoic acid on Omega-3 Index. Nutr Res. 2019;71:43-55.
44. Sprague M et al. Impact of sustainable feeds on omega-3 long-chain fatty acid levels in farmed Atlantic salmon, 2006–2015. Sci Rep. 2016:6:21892.
45. Walker RE et al. Predicting the effects of supplemental EPA and DHA on the omega-3 index. Am J Clin Nutr. 2019;110:1034-40.
46. Ramprasath VR et al. Supplementation of krill oil with high phospholipid content increases sum of EPA and DHA in erythrocytes compared with low phospholipid krill oil. Lipids Health Dis. 2015:14:142.
47. Ahn SH et al. Absorption rate of krill oil and fish oil in blood and brain of rats. Lipids Health Dis. 2018;17(1):162.
48. Allaire J et al. Supplementation with high-dose docosahexaenoic acid increases the Omega-3 Index more than high-dose eicosapentaenoic acid. Prostaglandins Leukot Essent Fatty Acids. 2017;120:8-14.
49. Meyer BJ et al. Effects of omega-3 long chain polyunsaturated fatty acid supplementation on cardiovascular mortality: the importance of the dose of DHA. Nutrients. 2017;9:1305.
50. Harris WS et al. The Omega-3 Index and relative risk for coronary heart disease mortality: estimation from 10 cohort studies. Atherosclerosis. 2017;262:51-54.
51. Flock MR et al. Determinants of erythrocyte omega-3 fatty acid content in response to fish oil supplementation: a dose-response randomized controlled trial. J Am Heart Assoc. 2013;2(6):e000513.
52. Billman GE. Homeostasis: the underappreciated and far too often ignored central organizing principle of physiology. Front Physiol. 2020;11:200.
53. Basil MC et al. Specialized pro-resolving mediators: endogenous regulators of infection and inflammation. Nat Rev Immunol. 2016;16:51-67.
54. Leuti A et al. Proresolving lipid mediators: endogenous modulators of oxidative stress. Oxid Med Cell Longev. 2019;2019:8107265.
55. Basil MC et al. Specialized pro-resolving mediators: endogenous regulators of infection and inflammation. Nat Rev Immunol. 2016;16(1):51-67.
56. Xu ZZ et al. Resolvins RvE1 and RvD1 attenuate inflammatory pain via central and peripheral actions. Nat Med. 2010;16:592-7.
57. Serhan CN et al. Macrophage proresolving mediator maresin 1 stimulates tissue regeneration and controls pain. FASEB J. 2012;26:1755-65.
58. Doran AC. Inflammation resolution: implications for atherosclerosis. Circ Res. 2022;130(1):130-48.
59. Salazar J et al. Specialized proresolving lipid mediators: a potential therapeutic target for atherosclerosis. Int J Mol Sci. 2022;23(6):3133.
60. Simonetto M et al. A novel anti-inflammatory role of omega-3 PUFAs in prevention and treatment of atherosclerosis and vascular cognitive impairment and dementia. Nutrients. 2019;11:2279.
61. Moro K et al. Resolvins and omega three polyunsaturated fatty acids: clinical implications in inflammatory diseases and cancer. World J Clin Cases. 2016;4(7):155-64.
62. Watson JE et al. Emerging class of omega-3 fatty acid endocannabinoids & their derivatives. Prostaglandins Other Lipid Mediat. 2019;143:106337.
63. De Melo Reis RA et al. Quality of life and a surveillant endocannabinoid system. Front Neurosci. 2021;15:747229.
64. Mechoulam R et al. The endocannabinoid system and the brain. Annu Rev Psychol. 2013;64:21-47.
65. Freitas HR et al. Polyunsaturated fatty acids and endocannabinoids in health and disease. Nutr Neurosci. 2018;21(10):695-714.
66. Saleh-Ghadimi S et al. Endocannabinoid system and cardiometabolic risk factors: A comprehensive systematic review insight into the mechanistic effects of omega-3 fatty acids. Life Sci. 2020;250:117556.
67. Roy J et al. Anti-tumorigenic properties of omega-3 endocannabinoid epoxides. J Med Chem. 2018;61(13):5569-79.
68. Fu Y et al. Associations among dietary omega-3 polyunsaturated fatty acids, the gut microbiota, and intestinal immunity. Mediators Inflamm. 2021;2021:8879227.
69. Fu Y et al. Associations among dietary omega-3 polyunsaturated fatty acids, the gut microbiota, and intestinal immunity. Mediators Inflamm. 2021;2021:8879227.
70. O’Keefe JH et al. Omega-3 fatty acid therapy: the tide turns for a fish story. Mayo Clin Proc. 2017;92:1-3.
71. Harris WS et al. Red blood cell polyunsaturated fatty acids and mortality in the womens’ health initiative study. J Clin Lipidol. 2017;11:250-59.
72. Ramirez JL et al. Peripheral artery disease is associated with a deficiency of erythrocyte membrane n-3 polyunsaturated fatty acids. Lipids. 2019;54:211-29.
73. Harris WS et al, Fatty Acids and Outcomes Research Consortium (FORCE). Blood n-3 fatty acid levels and total and cause-specific mortality from 17 prospective studies. Nat Commun. 2021;12(1):2329.
74. McBurney M et al. The omega-3 index is inversely associated with the neutrophil-lymphocyte ratio in adults. Prostaglandins Leukot Essent Fatty Acids. 2022;177:102397.
75. Berliner D et al. The omega-3 index in patients with heart failure: a prospective cohort study. Prostaglandins Leukot Essent Fatty Acids. 2019;140:34-41.
76. Hu Y et al. Marine omega-3 supplementation and cardiovascular disease: an updated meta-analysis of 13 randomized controlled trials involving 127.477 participants. J Am Heart Assoc. 2019;8(19):e013543.
77. Sekikawa A et al. Effect of high-dose marine omega-3 fatty acids on atherosclerosis: a systematic review and meta-analysis of randomized clinical trials. Nutrients. 2019;11(11):2599.
78. Heydari B et al. Effect of omega-3 acid ethyl esters on left ventricular remodeling after acute myocardial infarction. Circulation. 2016;134:378-91.
79. Von Schacky C. Omega-3 fatty acids in pregnancy – the case for a target Omega-3 Index. Nutrients. 2020;12:898.
80. Abdelrahman MA et al. Impact of n-3 polyunsaturated fatty acid intake in pregnancy on maternal health and birth outcomes: systematic review and meta-analysis from randomized controlled trails. Arch Gynecol Obstet. 2022 Mar 28.
81. Olsen SF et al. Plasma concentrations of long chain N-3 fatty acids in early and mid-pregnancy and risk of early preterm birth. EBioMedicine. 2018;35:325-33.
82. Hoge A et al. Impact of erythrocyte long-chain omega-3 polyunsaturated fatty acid levels in early pregnancy on birth outcomes: findings from a Belgian cohort study. J Perinatol. 2020;40:488-96.
83. Simmonds LA et al. Omega-3 fatty acid supplementation in pregnancy-baseline omega-3 status and early preterm birth: exploratory analysis of a randomised controlled trial. BJOG 2020; 127(8): 975-81.
84. Carlson SE et al. Higher dose docosahexaenoic acid supplementation during pregnancy and early preterm birth: a randomised, double-blind, adaptive-design superiority trial. EClinicalMedicine. 2021;36:100905.
85. Zhang MM et al. The efficacy and safety of omega-3 fatty acids on depressive symptoms in perinatal women: a meta-analysis of randomized placebo-controlled trials. Transl Psychiatry. 2020;10(1):193.
86. Hoge A et al. Imbalance between omega-6 and omega-3 polyunsaturated fatty acids in early pregnancy is predictive of postpartum depression in a Belgian cohort. Nutrients. 2019;11:E876.
87. Best KP et al. Omega-3 long-chain PUFA intake during pregnancy and allergic disease outcomes in the offspring: A systematic review and meta-analysis of observational studies and randomized controlled trials. Am J Clin Nutr. 2016;103:128-43.
88. Hansen S et al. Fish oil supplementation during pregnancy and allergic respiratory disease in the adult offspring. J Allergy Clin Immunol. 2017;139(1):104-111.
89. Jia Y et al. A dose response meta analysis of the association between the maternal omega 3 long chain polyunsaturated fatty acids supplement and risk of asthma/wheeze in offspring. BMC Pediatr. 2022;22(1):422.
90. Birch EE et al. The impact of early nutrition on incidence of allergic manifestations and common respiratory illnesses in children. J Pediatr. 2010;156(6):902-6.
91. Foiles AM et al. Formula with long-chain polyunsaturated fatty acids reduces incidence of allergy in early childhood. Pediatr Allergy Immunol. 2016;27(2):156-61.
92. Gellert S et al. Higher omega-3 index and DHA status in pregnant women compared to lactating women – results from a German nation-wide cross-sectional study. Prostaglandins Leukot Essent Fatty Acids. 2016;109:22-8.
93. Ter Borg S et al. Food consumption, nutrient intake and status during the first 1000 days of life in the Netherlands: a systematic review. Nutrients. 2019;11(4):860.
94. Kuipers RS et al. Maternal DHA equilibrium during pregnancy and lactation is reached at an erythrocyte DHA content of 8 g/100 g fatty acids.
J Nutr. 2011;141:418-27.
95. Kuipers RS et al. Maternal DHA equilibrium during pregnancy and lactation is reached at an erythrocyte DHA content of 8 g/100 g fatty acids.
J Nutr. 2011;141(3):418-27.
96. Stoutjesdijk E et al. Fish oil supplemental dose needed to reach 1g% DHA+EPA in mature milk. Prostaglandins Leukot Essent Fatty Acids. 2018;128:53-61.
97. Stonehouse W. Does consumption of long chain omega-3 PUFA enhance cognitive performance in healthy school-aged children and throughout adulthood? Evidence from clinical trials. Nutrients. 2014;6(7):2730-58.
98. Adjepong M et al. Whole blood n-3 fatty acids are associated with executive function in 2–6-year-old Northern Ghanaian children. J Nutr Biochem. 2018;57:287-93.
99. Dretsch MN et al. Effects of omega-3 fatty acid supplementation on neurocognitive functioning and mood in deployed U.S. Soldiers: a pilot study. Mil Med. 2014;179:396-403.
100. Tan ZS et al. Red blood cell omega-3 fatty acid levels and markers of accelerated brain aging. Neurology. 2012;78:658-64.
101. Lukaschek K et al. Cognitive impairment is associated with low omega-3 index in the elderly. Results from the KORA-Age study. Dementia Geriatr Cogn Dis. 2016;42:236-45.
102. Bigornia SJ et al. Prospective associations of erythrocyte composition and dietary intake of n-3 and n-6 PUFA with measures of cognitive function. Nutrients. 2018;10:1253.
103. Witte AV et al. Long-chain omega-3 fatty acids improve brain function and structure in older adults. Cereb Cortex. 2014;24:3059-68.
104. Kulzow N et al. Impact of omega-3 fatty acid supplementation on memory functions in healthy older adults. J Alzheimers Dis. 2016;51:713-25.
105. Alqarni A et al. Comparison of erythrocyte omega-3 index, fatty acids and molecular phospholipid species in people at ultra-high risk of developing psychosis and healthy people. Schizophr Res. 2020;226:44-51.
106. Canhada S et al. Omega-3 fatty acids’ supplementation in Alzheimer’s disease: a systematic review. Nutr Neurosci. 2018;21:529-38.
107. Chen C et al. Erythrocyte omega-3 index, ambient fine particle exposure and brain aging. Neurology. 2020;95:e995-e1007.
108. Langer-Gould A et al. Seafood, fatty acid biosynthesis genes and multiple sclerosis susceptibility. Mult Scler. 2020;26:1476-85.
109. AlAmmar WA et al. Effect of omega-3 fatty acids and fish oil supplementation on multiple sclerosis: a systematic review. Nutr Neurosci. 2019;24(7):569-79.
110. Chang JP et al. Nutritional neuroscience as mainstream of psychiatry: the evidence-based treatment guidelines for using omega-3 fatty acids as a new treatment for psychiatric disorders in children and adolescents. Clin Psychopharmacol Neurosci. 2020;18:469-83.
111. Mazahery H et al. Relationship between long chain n-3 polyunsaturated fatty acids and autism spectrum disorder: systematic review and meta-analysis of case-control and randomised controlled trials. Nutrients. 2017;9:155.
112. Fraguas D et al. Dietary interventions for autism spectrum disorder: a meta-analysis. Pediatrics. 2019;144:e20183218.
113. Guu TW et al. International Society for Nutritional Psychiatry Research Practice guidelines for omega-3 fatty acids in the treatment of major depressive disorder. Psychother Psychosom. 2019;88(5):263-73.
114. Patan MJ et al. Differential effects of DHA- and EPA-rich oils on sleep in healthy young adults: a randomized controlled trial. Nutrients. 2021;13(1):248.
115. Yokoi-Shimizu K et al. Effect of docosahexaenoic acid and eicosapentaenoic acid supplementation on sleep quality in healthy subjects: a randomized, double-blinded, placebo-controlled trial. Nutrients. 2022;14(19):4136.
116. Ogluszka M et al. Effect of omega-3 fatty acids on telomeres – are they the elixir of youth? Nutrients. 2022;14(18):3723.
117. Harris WS et al. Erythrocyte long-chain omega-3 fatty acid levels are inversely associated with mortality and with incident cardiovascular disease: the Framingham Heart Study. J Clin Lipidol. 2018;12:718-27.
118. Castro-Marreroa J et al. Low omega-3 index and polyunsaturated fatty acid status in patients with chronic fatigue syndrome/myalgic encephalomyelitis. Prostaglandins Leukot Essent Fatty Acids. 2018;139:20-4.
119. Zapata BR et al. Omega-3 index and clinical outcomes of severe COVID-19: preliminary results of a cross-sectional study. Int J Environ Res Public Health. 2021;18(15):7722.
120. McBurney M et al. Omega-3 index is directly associated with a healthy red blood cell distribution width. Prostaglandins Leukot Essent Fatty Acids. 2022;176:102376.
121. Ma MY et al. Omega-3 index and type 2 diabetes: systematic review and meta-analysis. Prostaglandins Leukot Essent Fatty Acids. 2021;174:102361.
122. Qian F et al. Fatty Acids and Outcomes Research Consortium (FORCE). N-3 fatty acid biomarkers and incident type 2 diabetes: an individual participant-level pooling project of 20 prospective cohort studies. Diabetes Care. 2021;44(5):1133-42.
123. Jang H et al. Omega-3 and omega-6 polyunsaturated fatty acids and metabolic syndrome: a systematic review and meta-analysis. Clin Nutr. 2020;39:767-73.
124. Von Schacky C et al. Low omega-3 index in 106 German elite winter endurance athletes – a pilot study. Int J Sport Nutr Exerc Metab. 2014;24:559-64.
125. Anzalone A et al. The omega-3 index in national collegiate athletic association division I collegiate football athletes. J Athl Train. 2019;54:7-11.
126. Davinelli S et al. Relationship between distance run per week, omega-3 index, and arachidonic acid (AA)/eicosapentaenoic acid (EPA) ratio: an observational retrospective study in non-elite runners. Front Physiol. 2019;10:487.
127. Kim J et al. A review of nutritional intervention on delayed onset muscle soreness. Part I. J Exerc Rehabil. 2014;10:349-56.
128. Ochi E et al. Eicosapentaenoic acid (EPA) and docosahexaenoic acid (DHA) in muscle damage and function. Nutrients. 2018;10:E552.
129. Hudek R et al. Degenerative rotator cuff tears are associated with a low omega-3 index. Prostaglandins Leukot Essent Fatty Acids. 2019;148:35-40.
130. Bozzatello P et al. Polyunsaturated fatty acids: what is their role in treatment of psychiatric disorders? Int J Mol Sci. 2019;20:5257.
131. Gajos JM et al. The effect of omega-3 fatty acids on aggression: a meta-analysis. Neurosci Biobehav Rev. 2016;69:147-58.
132. Stoodley I et al. Higher omega-3 index is associated with better asthma control and lower medication dose: a cross-sectional study. Nutrients. 2020;12:74.
133. Luo XD et al. High-dose omega-3 polyunsaturated fatty acid supplementation might be more superior than low-dose for major depressive disorder in early therapy period: a network meta-analysis. BMC Psychiatry. 2020;20:248.
134. DiNicolantonio JJ et al. Importance of maintaining a low omega-6/omega-3 ratio for reducing inflammation. Open Heart. 2018;5(2):e000946.
135. Custodero C et al. Evidence-based nutritional and pharmacological interventions targeting chronic low-grade inflammation in middle-age and older adults: a systematic review and meta-analysis. Ageing Res Rev. 2018;46:42-59.
136. Tan A et al. Supplementation with eicosapentaenoic acid and docosahexaenoic acid reduces high levels of circulating proinflammatory cytokines in aging adults: A randomized, controlled study. Prostaglandins Leukot Essent Fatty Acids. 2018;132:23-9.
137. Von Schacky C. Omega-3 fatty acids: anti-arrhythmic, pro-arrhythmic, or both? Front Physiol. 2012;3:88.
138. Rix TA et al. Omega-3 fatty acids in adipose tissue and risk of atrial fibrillation. Eur J Clin Invest. 2022;52(1):e13649.
139. Sakamoto A et al. Marine-derived omega-3 polyunsaturated fatty acids and heart failure: current understanding for basic to clinical relevance. Int J Mol Sci. 2019;20(16):4025.
140. Cupino A et al. Are total omega-3 and omega-6 polyunsaturated fatty acids predictors of fatal stroke in the Adventist Health Study 2 prospective cohort? PLoS One. 2022;17(9):e0274109.
141. Ueno Y et al. Omega-3 polyunsaturated fatty acids and stroke burden. Int J Mol Sci. 2019;20:5549.
142. Tulowiecka N et al. The role of resolvins: EPA and DHA derivatives can be useful in the prevention and treatment of ischemic stroke. Int J Mol Sci. 2020;21:7628.
143. DiNicolantonio JJ et al. Importance of maintaining a low omega-6/omega-3 ratio for reducing platelet aggregation, coagulation and thrombosis. Open Heart. 2019;6(1):e001011.
144. Reiner MF et al. Omega-3 fatty acids predict recurrent venous thromboembolism or total mortality in elderly patients with acute venous thromboembolism. J Thromb Haemost. 2017;15(1):47-56.
145. Song C et al. The role of omega-3 polyunsaturated fatty acids eicosapentaenoic and docosahexaenoic acids in the treatment of major depression and Alzheimer’s disease: acting separately or synergistically? Prog Lipid Res. 2016;62:41-54.
146. Shin S. Regulation of adipose tissue biology by long-chain fatty acids: metabolic effects and molecular mechanisms. J Obes Metab Syndr. 2022;31:147-60.
147. Agrawal R et al. ‘Metabolic syndrome’ in the brain: deficiency in omega-3 fatty acid exacerbates dysfunctions in insulin receptor signalling and cognition. J Physiol. 2012;590(10):2485-99.
148. Simopoulos AP. Dietary omega-3 fatty acid deficiency and high fructose intake in the development of metabolic syndrome, brain metabolic abnormalities, and non-alcoholic fatty liver disease. Nutrients. 2013;5(8):2901-23.
149. Khalili L et al. Effect of n-3 (Omega-3) polyunsaturated fatty acid supplementation on metabolic and inflammatory biomarkers and body weight in patients with type 2 diabetes mellitus: a systematic review and meta-analysis of RCTs. Metabolites. 2021;11:742.
150. Zhong N et al. The efficacy of omega-3 fatty acid for gestational diabetes: a meta-analysis of randomized controlled trials. Gynecol Endocrinol. 2019;35(1):4-9.
151. Gao L et al. The impact of omega-3 fatty acid supplementation on glycemic control in patients with gestational diabetes: a systematic review and meta-analysis of randomized controlled studies. J Matern Fetal Neonatal Med. 2020;33(10):1767-73.
152. Skulas-Ray AC et al. Omega-3 fatty acids for the management of hypertriglyceridemia: a science advisory from the American Heart Association. Circulation. 2019;140(12):e673-e691.
153. Lee CH et al. Effects of omega-3 polyunsaturated fatty acid supplementation on non-alcoholic fatty liver: a systematic review and meta-analysis. Nutrients. 2020;12:2769.
154. De Castro GS et al. Non-alcoholic fatty liver disease and its treatment with n-3 polyunsaturated fatty acids. Clin Nutr. 2018;37(1):37-55.
155. Sun Q et al. Association between omega-3/6 fatty acids and cholelithiasis: a mendelian randomization study. Front Nutr. 2022;9:964805.
156. Cariati A et al. Could omega-3 fatty acid prolonged intake reduce the incidence of symptomatic cholesterol gallstones disease? Clin Nutr. 2013;32(3):486-7.
157. Jiang H et al. Dietary omega-3 polyunsaturated fatty acids and fish intake and risk of age-related macular degeneration. Clin Nutr. 2021;40(12):5662-73.
158. Zhong Y et al. Dietary fatty acid intake, plasma fatty acid levels, and the risk of age-related macular degeneration (AMD): a dose-response meta-analysis of prospective cohort studies. Eur J Nutr. 2021;60(6):3013-27.
159. Ren J et al. Long-chain polyunsaturated fatty acids and their metabolites regulate inflammation in age-related macular degeneration. J Inflamm Res. 2022;15:865-80.
160. Downie LE et al. Oral omega-3 supplementation lowers intraocular pressure in normotensive adults. Trans Vis Sci Tech. 2018;7(3):1.
161. Perez de Arcelus M et al. Omega 3:6 ratio intake and incidence of glaucoma: the SUN cohort. Clin Nutr. 2014;33:1041-5.
162. Wang YE et al. Association of dietary fatty acid intake with glaucoma in the United States. JAMA Ophthalmol. 2018;136(2):141-7.
163. Eynard AR et al. Role of Omega-3 polyunsaturated fatty acids in diabetic retinopathy: a morphological and metabolically cross talk among blood retina barriers damage, autoimmunity and chronic inflammation. Lipids Health Dis. 2019;18(1):114.
164. Sala-Vila A et al. Prevención con Dieta Mediterránea (PREDIMED) Investigators. Dietary marine Omega-3 fatty acids and incident sight-threatening retinopathy in middle-aged and older individuals with type 2 diabetes: prospective investigation from the PREDIMED trial. JAMA Ophthalmol. 2016;134(10):1142-9.
165. Hirakata T et al. Dietary Omega-3 fatty acids alter the lipid mediator profile and alleviate allergic conjunctivitis without modulating Th2 immune responses. FASEB J. 2019;33(3):3392-403.
166. Downie LE et al. Omega-3 and omega-6 polyunsaturated fatty acids for dry eye disease. Cochrane Database Syst Rev. 2019;2019(12):CD011016.
167. Giannaccare G et al. Efficacy of omega-3 fatty acid supplementation for treatment of dry eye disease: a meta-analysis of randomized clinical trials. Cornea. 2019;38(5):565-573.
168. Lem DW et al. Can nutrition play a role in ameliorating digital eye strain? Nutrients. 2022;14:4005.
169. Pan M et al. Dietary Omega-3 polyunsaturated fatty acids are protective for myopia. Proc Natl Acad Sci USA. 2021;118(43):e2104689118.
170. Maghsoumi-Norouzabad L et al. Effects of omega-3 fatty acids on the frequency, severity, and duration of migraine attacks: a systematic review and meta-analysis of randomized controlled trials. Nutr Neurosci. 2018;21:614-23.
171. Soveyd N et al. Molecular mechanisms of omega-3 fatty acids in the migraine headache. Iran J Neurol. 2017;16(4):210-7.
172. Ramsden C et al. Targeted alterations in dietary n-3 and n-6 fatty acids improve life functioning and reduce psychological distress among patients with chronic headache: a secondary analysis of a randomized trial. Pain. 2015; 156:587-96.
173. Ramsden CE et al. Targeted alteration of dietary n-3 and n-6 fatty acids for the treatment of chronic headaches: a randomized trial. Pain. 2013;154(11):2441-51.
174. Lewis M et al. Therapeutic use of omega-3 fatty acids in severe head trauma. Am J Emerg Med. 2013;31(1):273.e5-8.
175. Heileson JL et al. The effect of omega-3 fatty acids on a biomarker of head trauma in NCAA football athletes: a multi-site, non-randomized study. J Int Soc Sports Nutr. 2021;18(1):65.
176. Ko GD et al. Omega-3 fatty acids for neuropathic pain: case series. Clin J Pain. 2010;26(2):168-72.
177. Durán AM et al. Dietary omega-3 polyunsaturated fatty-acid supplementation upregulates protective cellular pathways in patients with type 2 diabetes exhibiting improvement in painful diabetic neuropathy. Nutrients. 2022;14(4):761.
178. Bradbury J et al. Are the adaptogenic effects of omega 3 fatty acids mediated via inhibition of proinflammatory cytokines? Evid Based Complement Alternat Med. 2012;2012:209197.
179. Carter JR et al. Fish oil and neurovascular reactivity to mental stress in humans. Am J Physiol Regul Integr Comp Physiol. 2013;304(7):R523-30.
180. Jahangard L et al. Omega-3-polyunsatured fatty acids (O3PUFAs), compared to placebo, reduced symptoms of occupational burnout and lowered morning cortisol secretion. Psychoneuroendocrinology. 2019;109:104384.
181. Watanabe N et al. Omega-3 fatty acids for a better mental state in working populations – Happy Nurse Project: a 52-week randomized controlled trial. J Psychiatr Res. 2018;102:72-80.
182. Harrison TM et al. Omega-3 fatty acids and autonomic function in adolescents with anorexia: a randomized trial. Pediatr Res. 2022;92(4):1042-50.
183. Karaszewska DM et al. Marine omega-3 fatty acid supplementation for borderline personality disorder: a meta-analysis. J Clin Psychiatry. 2021;82(3):20r13613.
184. Hibbeln JR et al. The potential for military diets to reduce depression, suicide, and impulsive aggression: a review of current evidence for omega-3 and omega-6 fatty acids. Mil Med. 2014;179(Suppl. 11):117-28.
185. Bellino S et al. Efficacy of polyunsaturated fatty acids (PUFAs) on impulsive behaviours and aggressiveness in psychiatric disorders. Int J Mol Sci. 2021;22:620.
186. Su KP et al. Association of use of omega-3 polyunsaturated fatty acids with changes in severity of anxiety symptoms: a systematic review and meta-analysis. JAMA Netw Open. 2018;1(5):e182327.
187. Balanzá-Martínez V et al. Therapeutic use of omega-3 fatty acids in bipolar disorder. Expert Rev Neurother. 2011;11(7):1029-47.
188. Saunders EF et al. Omega-3 and omega-6 polyunsaturated fatty acids in bipolar disorder: a review of biomarker and treatment studies. J Clin Psychiatry. 2016;77(10):e1301-8.
189. Parletta N et al. People with schizophrenia and depression have a low omega-3 index. Prostaglandins Leukot Essent Fat Acids. 2016;110:42-7.
190. Hsu MC et al. Beneficial effects of omega-3 fatty acid supplementation in schizophrenia: possible mechanisms. Lipids Health Dis. 2020;19(1):159.
191. Sigaux H et al. Impact of type and dose of oral polyunsaturated fatty acid supplementation on disease activity in inflammatory rheumatic diseases: a systematic literature review and meta analysis. Arthritis Res Ther. 2022;24(1):100.
192. Cordingley DM et al. Omega-3 fatty acids for the management of osteoarthritis: a narrative review. Nutrients. 2022;14:3362.
193. Sibille KT et al. Omega-6: omega-3 PUFA ratio, pain, functioning, and distress in adults with knee pain. Clin J Pain. 2018;34(2):182-9.
194. NaPier Z et al. Omega-3 fatty acid supplementation reduces intervertebral disc degeneration. Med Sci Monit. 2019;25:9531-7.
195. Bird JK et al. The effect of long chain omega-3 polyunsaturated fatty acids on muscle mass and function in sarcopenia: a scoping systematic review and meta-analysis. Clin Nutr ESPEN. 2021;46:73-86.
196. Dupont J et al. The role of omega-3 in the prevention and treatment of sarcopenia. Aging Clin Exp Res. 2019;31(6):825-36.
197. Gray SR et al. Fish oil-derived n-3 polyunsaturated fatty acids for the prevention and treatment of sarcopenia. Curr Opin Clin Nutr Metab Care. 2018;21:104-9.
198. Huang YH et al. Effects of omega-3 fatty acids on muscle mass, muscle strength and muscle performance among the elderly: a meta-analysis. Nutrients. 2020;12:3739.
199. Azuma MM et al. The use of omega-3 fatty acids in the treatment of oral diseases. Oral Dis. 2022;28(2):264-74.
200. Balic A et al. Omega-3 versus omega-6 polyunsaturated fatty acids in the prevention and treatment of inflammatory skin diseases. Int J Mol Sci. 2020;21(3):741.
201. Li Y et al. The causal association of polyunsaturated fatty acids with allergic disease: a two-sample Mendelian randomization study. Front Nutr. 2022;9:962787.
202. Sawane K et al. Dietary omega-3 fatty acid dampens allergic rhinitis via eosinophilic production of the anti-allergic lipid mediator 15-hydroxyeicosapentaenoic acid in mice. Nutrients. 2019;11(12):2868.
203. Magnusson J et al. Fish and polyunsaturated fat intake and development of allergic and nonallergic rhinitis. J Allergy Clin Immunol. 2015;136(5):1247-53.
204. Duarte-García A et al. Effect of omega-3 fatty acids on systemic lupus erythematosus disease activity: a systematic review and meta-analysis. Autoimmun Rev. 2020;19(12):102688.
205. Pradelli L et al. Cost-effectiveness of parenteral nutrition containing Omega-3 fatty acids in hospitalized adult patients from 5 European countries and the US. JPEN J Parenter Enteral Nutr. 2021;45(5):999-1008.
206. Wei L et al. Multi-targeted therapy of cancer by omega-3 fatty acids – an update. Cancer Lett. 2022;526:193-204.
207. Freitas RD et al. Protective effects of omega-3 fatty acids in cancer-related complications. Nutrients. 2019;11(5):945.
208. Jin X et al. Omega-3 polyunsaterated fatty acids improve quality of life and survival, but not body weight in cancer cachexia: a systematic review and meta-analysis of controlled trials. Nutr Res. 2022;107:165-78.
209. Gorjao R et al. New insights on the regulation of cancer cachexia by N-3 polyunsaturated fatty acids. Pharmacol Ther. 2019;196:117-34.
210. Wang T et al. Omega-3 polyunsaturated fatty acids, gut microbiota, microbial metabolites, and risk of colorectal adenomas. Cancers. 2022;14:4443.
211. Hosseini B et al. The effect of omega-3 fatty acids, EPA, and/or DHA on male infertility: a systematic review and meta-analysis. J Diet Suppl. 2019;16(2):245-56.
212. Falsig AL et al. The influence of omega-3 fatty acids on semen quality markers: a systematic PRISMA review. Andrology. 2019;7(6):794-803.
213. Stanhiser J et al. Omega-3 fatty acid supplementation and fecundability. Hum Reprod. 2022;37(5):1037-46.
214. Nehra D et al. Prolonging the female reproductive lifespan and improving egg quality with dietary omega-3 fatty acids. Aging Cell. 2012;11(6):1046-54.
215. Chiu YH et al. Serum omega-3 fatty acids and treatment outcomes among women undergoing assisted reproduction. Hum Reprod. 2018;33(1):156-65.
216. Lass A et al. Omega-3 polyunsaturated fatty acids and IVF treatment. Reprod Biomed Online. 2019;38(1):95-9.
217. Mohammadi MM et al. Effect of omega-3 fatty acids on premenstrual syndrome: a systematic review and meta-analysis. J Obstet Gynaecol Res. 2022;48(6):1293-1305.
218. Mohammadi MM et al. The impact of omega-3 polyunsaturated fatty acids on primary dysmenorrhea: a systematic review and meta-analysis of randomized controlled trials. Eur J Clin Pharmacol. 2022;78(5):721-31.
219. Yuan J et al. Efficacy of omega-3 polyunsaturated fatty acids on hormones, oxidative stress, and inflammatory parameters among polycystic ovary syndrome: a systematic review and meta-analysis. Ann Palliat Med. 2021;10(8):8991-9001.
220. Salek M et al. N-3 fatty acids as preventive and therapeutic agents in attenuating PCOS complications. EXCLI J. 2019;18:558-75.
221. Sakr HI et al. The Effect of omega-3 therapy on induced hyperacidity. JMSCR. 2017;4(2):9222-34.
222. Chua CS et al. Fatty acid components in Asian female patients with irritable bowel syndrome. Medicine (Baltimore). 2017;96(49):e9094.
223. Durkin LA et al. Omega-3 polyunsaturated fatty acids and the intestinal epithelium – a review. Foods. 2021;10:199.
224. Serini S et al. New insights on the effects of dietary omega-3 fatty acids on impaired skin healing in diabetes and chronic venous leg ulcers. Foods. 2021;10(10):2306.
225. Kim HH et al. Photoprotective and anti-skin-aging effects of eicosapentaenoic acid in human skin in vivo. J Lipid Res. 2006;47(5):921-30.
226. Adams S et al. Relationship between serum omega-3 fatty acid and asthma endpoints. Int J Environ Res Public Health. 2018;16(1):43.
227. Kotlyarov S et al. Anti-inflammatory function of fatty acids and involvement of their metabolites in the resolution of inflammation in chronic obstructive pulmonary disease. Int J Mol Sci. 2021;22:12803.
228. Nursyifa Fadiyah N et al. Potential of omega 3 supplementation for coronavirus disease 2019 (COVID-19): a scoping review. Int J Gen Med. 2022;15:3915-22.
229. Mazidimoradi A et al. The effect of polyunsaturated fatty acids on the severity and mortality of COVID patients: a systematic review. Life Sci. 2022;299:120489.
230. Ladesich JB et al. Membrane level of omega-3 docosahexaenoic acid is associated with severity of obstructive sleep apnea. J Clin Sleep Med. 2011;7(4):391-6.
231. Tittus J et al. Omega-3 index and obstructive sleep apnea: a cross-sectional study. J Clin Sleep Med. 2017;13(10):1131-1136.
232. Li WL et al. Dietary omega-3 fatty acid intake and mortality in CKD population: a 1999-2014 NHANES analysis. Am J Nephrol. 2021;52(12):909-18.
233. Lin YL et al. Omega-3 fatty acids improve chronic kidney disease-associated pruritus and inflammation. Medicina. 2022;58:796.
234. Hu J et al. Omega-3 fatty acid supplementation as an adjunctive therapy in the treatment of chronic kidney disease: a meta-analysis. Clinics (Sao Paulo). 2017;72(1):58-64.
235. Rogers AL et al. The efficacy of polyunsaturated fatty acids as protectors against calcium oxalate renal stone formation: a review. Nutrients. 2020;12:1069.
236. Daak A et al. Omega-3 fatty acids are a potential therapy for patients with sickle cell disease. Nat Rev Dis Primers. 2018;4(1):15.
237. Sins JW et al. Pharmacotherapeutical strategies in the prevention of acute, vaso-occlusive pain in sickle cell disease: a systematic review. Blood Adv. 2017;1(19):1598-1616.
238. Daak AA et al. Double-blind, randomized, multicenter phase 2 study of SC411 in children with sickle cell disease (SCOT trial). Blood Adv. 2018;2(15):1969-1979.
239. Feuchtner G et al. The effect of omega-3 fatty acids on coronary atherosclerosis quantified by coronary computed tomography angiography. Clin Nutr. 2021;40(3):1123-9.
240. Palmu J et al. Eicosanoid inflammatory mediators are robustly associated with blood pressure in the general population. J Am Heart Assoc. 2020;9(19):e017598.
241. Zhang X et al. Omega-3 polyunsaturated fatty acids intake and blood pressure: a dose-response meta-analysis of randomized controlled trials. J Am Heart Assoc. 2022;11(11):e025071.

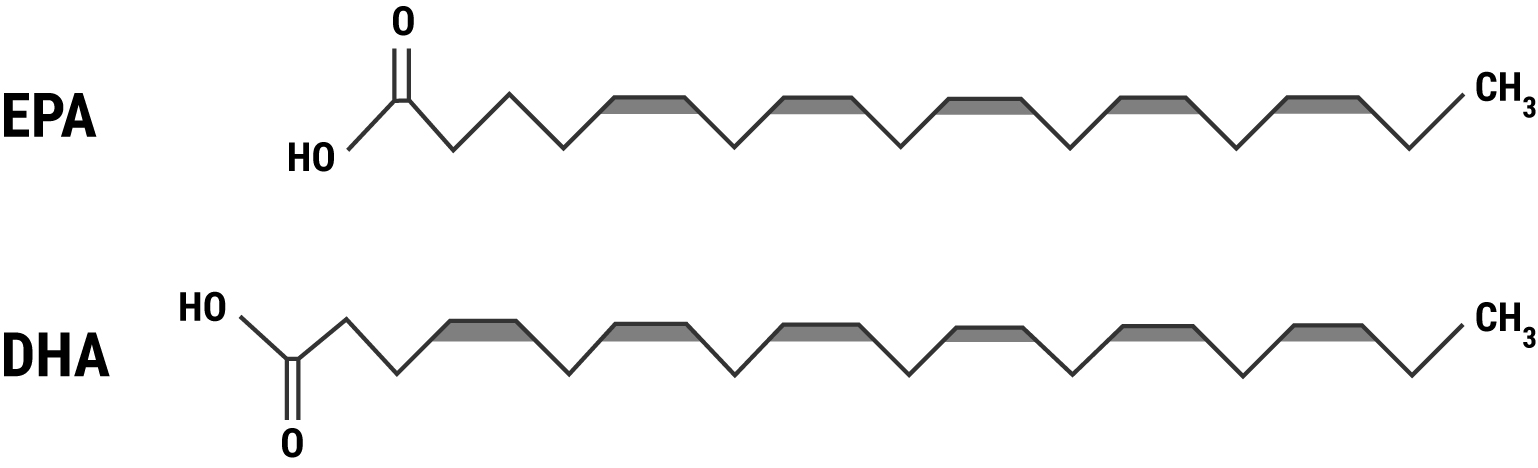
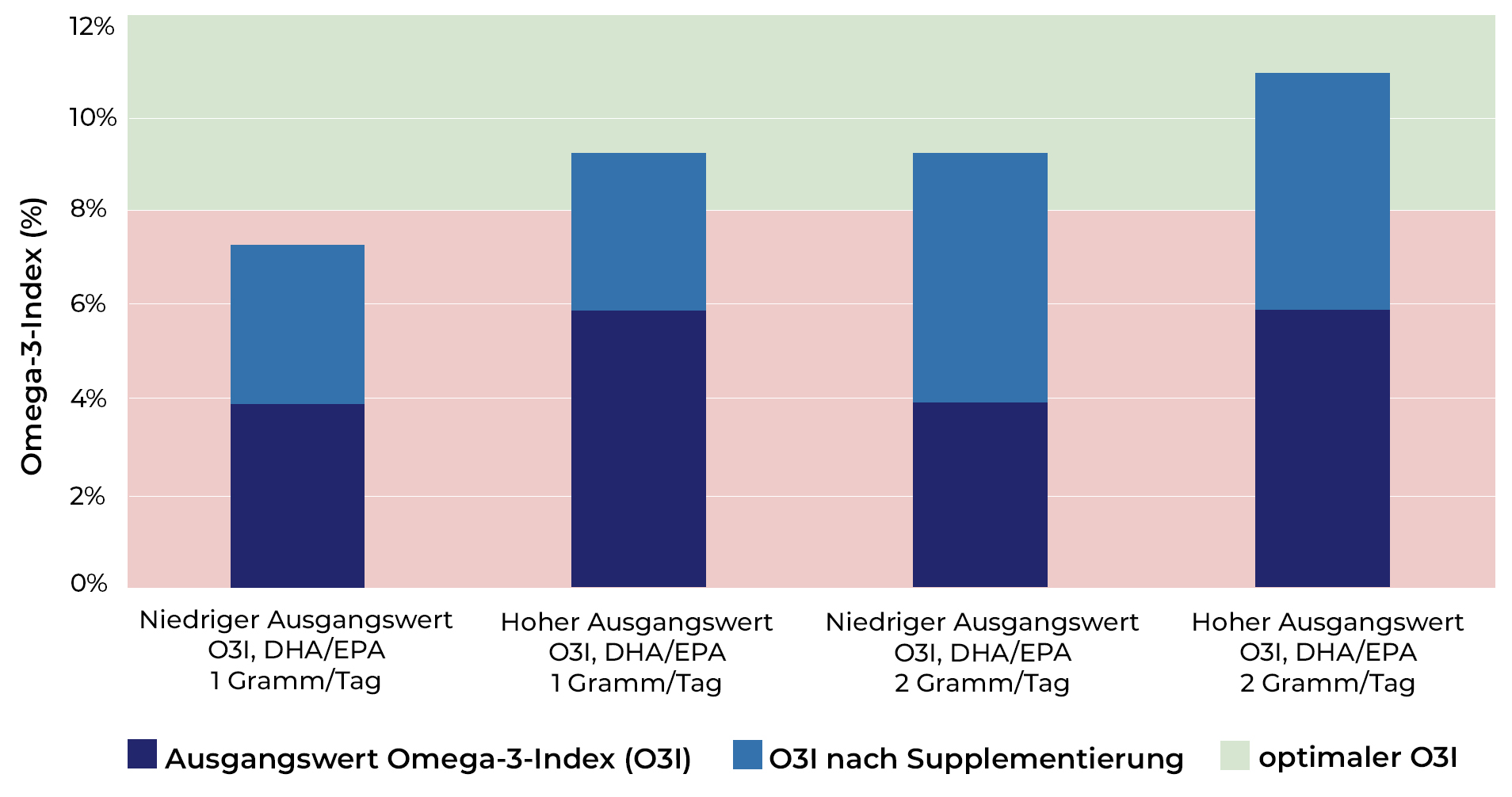


Comments are closed.